题目内容
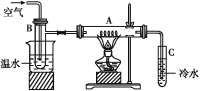
【题目】已知SO2+I2+2H2O===H2SO4+2HI,某化学兴趣小组选用下列实验装置,测定工业原料气(含SO2、N2、O2)中SO2的含量。

(1)若原料气从左流向右时,上述装置组装连接的顺序:原料气→__________________(填“a”“b”“c”“d”“e”)。
(2)装置Ⅱ中发生反应的离子方程式为_____________;当装置Ⅱ中出现________现象时,立即停止通气。
(3)若碘溶液的浓度为0.05 mol/L、体积为20 mL,收集到的N2与O2的体积为297.6 mL(已折算为标准状况下的体积),SO2的体积分数为________。
【答案】c→d→b→a→eSO2+I2+2H2O===4H++SO42-+2I-蓝色褪去7%
【解析】
(1)本题考查了排水法的连接顺序;SO2用碘吸收,氧气和氮气不溶于水,可用通过排水法测量起体积。
(2)根据方程式可直接写出离子方程式。
(3)找出SO2与I2对应关系,求出SO2体积,可以求出混合气体中SO2的体积分数。
:(1)SO2用碘吸收,氧气和氮气不溶于水,可用通过排水法测量起体积;所以正确的顺序为原料气→c→d→b→a→e;正确答案:c→d→b→a→e。
(2)二氧化硫、碘与水混合反应生成硫酸和氢碘酸,反应的离子方程式为:SO2+I2+2H2O=4H++SO42-+2I-;由于碘遇淀粉显蓝色,所以当溶液蓝色褪去时,即停止通气;正确答案:SO2+I2+2H2O===4H++SO42-+2I-; 蓝色褪去。
(3)由反应方程式可知: SO2---I2关系可知:V(SO2)=0.05×20×10-3×22.4×1000=22.4mL,则SO2的体积分数为=22.4/(297.6+22.4)×100%=7%;正确答案:7%。

 阅读快车系列答案
阅读快车系列答案