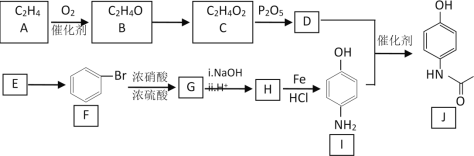
题目内容
【题目】实验室里用如图所示装置制取纯净的无水CuCl2。试回答下列问题:

(1)写出烧瓶中发生反应的化学方程式和离子方程式:__________________________。
(2)B处盛有饱和食盐水(或水),其作用是_____________。
(3)C处盛放的试剂__________(填名称),其作用是_____________。
(4)E处盛有_______(填名称),发生反应的离子方程式为_____________。
【答案】MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O、MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O、MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 除去Cl2中的HCl 浓H2SO4 除水,干燥氯气 NaOH溶液 2OH-+Cl2=Cl-+ClO-+H2O
Mn2++Cl2↑+2H2O 除去Cl2中的HCl 浓H2SO4 除水,干燥氯气 NaOH溶液 2OH-+Cl2=Cl-+ClO-+H2O
【解析】
二氧化锰与浓盐酸反应制备的氯气中含有氯化氢和水蒸气杂质,制备无水CuCl2前需要除去氯气中的杂质气体,结合氯气、氯化氢的性质分析解答。
(1)A为制备氯气装置,装置A中反应为二氧化锰与盐酸反应生成氯化锰、氯气、水,反应方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,离子反应方程式为MnO2+4H++2Cl-=Mn2++Cl2+2H2O,故答案为:MnO2+4HCl(浓)
MnCl2+Cl2↑+2H2O,离子反应方程式为MnO2+4H++2Cl-=Mn2++Cl2+2H2O,故答案为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O、MnO2+4H++2Cl-=Mn2++Cl2+2H2O;
MnCl2+Cl2↑+2H2O、MnO2+4H++2Cl-=Mn2++Cl2+2H2O;
(2)浓盐酸具有挥发性,所以制备的氯气中含有氯化氢,氯化氢极易溶于水,氯气的溶解度较小,所以可用饱和食盐水(或水)除去氯气气体中的氯化氢,故答案为:除去Cl2中的HCl;
(3)因为题中要求制取纯净的无水CuCl2,所以要除去氯气中混有的水蒸气,且不引进新的杂质,所以选择浓硫酸干燥,故答案为:浓H2SO4;除水,干燥氯气;
(4)尾气中含有氯气,氯气有毒,会污染环境,不能直接排放到大气中,可以用氢氧化钠溶液吸收,氯气与氢氧化钠反应生成氯化钠、次氯酸钠与水,反应离子方程式为Cl2+2OH-===Cl-+ClO-+H2O,故答案为:NaOH溶液;Cl2+2OH-===Cl-+ClO-+H2O。

 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案【题目】某同学利用如图装置模拟工业生产制备了少量硝酸,请结合所学知识完成下列问题。
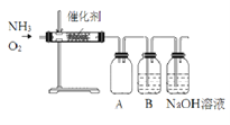
(1)实验时先用酒精喷灯加热催化剂,然后通入反应气体,当催化剂红热后撤离酒精喷灯,催化剂始终保持红热,温度可达到700℃以上。下列图示中,能够正确表示该反应过程能量变化的是_____(填字母)。
A.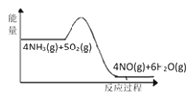
B.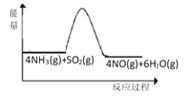
C.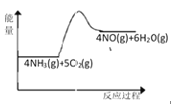
(2)高温时,2NO2(g)![]() 2NO(g)+O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2molNO2分解时,反应会_____(填“吸收”或“放出”)_____kJ能量。
2NO(g)+O2(g),因此氨气与氧气反应难以生成NO2。根据下列数据计算,当2molNO2分解时,反应会_____(填“吸收”或“放出”)_____kJ能量。
NO2(g)![]() N(g)+2O(g)
N(g)+2O(g)
NO(g)![]() N(g)+O(g)
N(g)+O(g)
O2(g)![]() 2O(g)
2O(g)
(3)在2L的密闭绝热容器中,通入等物质的量的NO和O2气体,n(NO)随时间的变化如下表:
t/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.012 | 0.008 | 0.005 | 0.004 | 0.004 |
①反应开始至第2s时,NO的平均反应速率为_____。
②在第5s时,O2的转化率为_____。
③容器中混合气体压强与反应开始时的压强比值为_____。
④下列能说明反应已达平衡的是_____。
a.单位时间内,每生成一定物质的量浓度的NO,同时有相同物质的量浓度的/span>NO2生成
b.气体混合物物质的量不再改变
c.气体混合物平均相对分子质量不再改变
d.容器内温度不再发生变化
e.密闭容器内气体颜色不再改变
f.混合气的密度不再改变