МвДҝДЪИЭ
ЎҫМвДҝЎҝ№эСх»ҜДЖіЈУГЧчЖҜ°ЧјБЎўЙұҫъјБЎўПы¶ҫјБЈ¬ДЬУлЛ®әН¶юСх»ҜМјөИОпЦК·ўЙъ·ҙУҰЈ¬ұЈҙжІ»өұКұИЭТЧұдЦКЎЈДіКөСйРЎЧйТФ№эСх»ҜДЖОӘСРҫҝ¶ФПуҪшРРБЛИзПВКөСйЎЈ
(1)МҪҫҝТ»°ьNa2O2СщЖ·КЗ·сТСҫӯұдЦКЈәИЎЙЩБҝСщЖ·Ј¬Ҫ«ЖдИЬҪвЈ¬јУИл__________ИЬТәЈ¬ід·ЦХсөҙәуУР°ЧЙ«іБөнЈ¬ЦӨГчNa2O2ТСҫӯұдЦКЎЈ
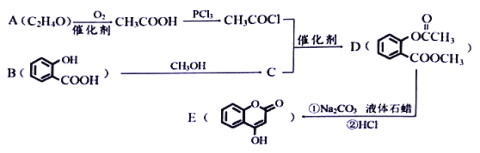
(2)ёГКөСйРЎЧйОӘБЛҙЦВФІв¶Ё№эСх»ҜДЖөДЦКБҝ·ЦКэЈ¬іЖИЎБЛm gСщЖ·Ј¬ІўЙијЖУГИзНјЧ°ЦГАҙІв¶Ё№эСх»ҜДЖөДЦКБҝ·ЦКэЎЈ

ўЩЧ°ЦГЦРТЗЖчaөДГыіЖКЗ_________Ј¬Ч°ЦГDөДЧчУГКЗ________________Ј»
ўЪҪ«ТЗЖчБ¬ҪУәГТФәуЈ¬ұШРлҪшРРөДөЪТ»ІҪІЩЧчКЗ_____________________Ј»
ўЫРҙіцЧ°ЦГCЦР·ўЙъЦчТӘ·ҙУҰөД»ҜС§·ҪіМКҪ_______________________Ј»
ўЬ·ҙУҰҪбКшәуЈ¬ФЪ¶БИЎКөСйЦРЙъіЙЖшМеөДМе»эКұЈ¬ДгИПОӘәПАнөДКЗ________(МоРтәЕ)Ј»
a.¶БИЎЖшМеМе»эЗ°Ј¬РиАдИҙөҪКТОВ
b.өчХыБҝНІК№EЎўFДЪТәГжёЯ¶ИПаН¬
c.КУПЯУл°јТәГжөДЧоөНөгПаЖҪКұ¶БИЎБҝНІЦРЛ®өДМе»э
ўЭ¶БіцБҝНІДЪЛ®өДМе»эәуЈ¬Ҫ«ЖдХЫЛгіЙұкЧјЧҙҝцПВСхЖшөДМе»эОӘVmLЈ¬ФтСщЖ·ЦР№эСх»ҜДЖөДЦКБҝ·ЦКэОӘ___________ЎЈ
Ўҫҙр°ёЎҝBaCl2 ·ЦТәВ©¶· ОьКХСхЖшЦР»мУРөД¶юСх»ҜМјЖшМе јмІйЧ°ЦГЖшГЬРФ 2Na2O2+2CO2=2Na2CO3+O2 abc ![]()
ЎҫҪвОцЎҝ
Ч°ЦГAКЗЦЖұё¶юСх»ҜМјЈ¬Ч°ЦГBУГАҙіэИҘ¶юСх»ҜМјЦРөДВИ»ҜЗвЈ¬Ч°ЦГCЦР№эСх»ҜДЖУл¶юСх»ҜМј·ҙУҰІъЙъСхЖшЈ¬АыУГЗвСх»ҜДЖИЬТәОьКХСхЖшЦРөД¶юСх»ҜМјЈ¬ЧоәуАыУГЕЕЛ®·ЁІвБҝСхЖшөДМе»эЈ¬ҫЭҙЛҪвҙрЎЈ
(1)№эСх»ҜДЖФЪҝХЖшЦРұдЦК»бЧоәуЙъіЙМјЛбДЖ№ММеЈ¬МҪҫҝТ»°ь№эСх»ҜДЖСщЖ·КЗ·сТСҫӯұдЦКЈ¬ҝЙТФАыУГМјЛбёщАлЧУәНұөАлЧУҪбәПЙъіЙМјЛбұө°ЧЙ«іБөнЦӨГчNa2O2ТСҫӯұдЦКЈ¬№Кҙр°ёОӘЈәBaCl2Ј»
(2)ўЩЧ°ЦГЦРТЗЖчaөДГыіЖКЗЈә·ЦТәВ©¶·Ј¬Ч°ЦГDөДЧчУГКЗЈәОьКХСхЖшЦР»мУРөД¶юСх»ҜМјЖшМеЈ¬№Кҙр°ёОӘЈә·ЦТәВ©¶·Ј»ОьКХСхЖшЦР»мУРөД¶юСх»ҜМјЖшМеЈ»
ўЪКөСйМҪҫҝІв¶Ё·Ҫ·ЁКЗІв¶Ё¶юСх»ҜМјәН№эСх»ҜДЖ·ҙУҰЙъіЙөДСхЖшЈ¬Ч°ЦГЦРұШРлКЗЖшГЬРФНкәГЈ¬Ҫ«ТЗЖчБ¬ҪУәГТФәуЈ¬ұШРлҪшРРөДөЪТ»ІҪІЩЧчКЗјмІйЧ°ЦГөДЖшГЬРФЈ¬№Кҙр°ёОӘЈәјмІйЧ°ЦГөДЖшГЬРФЈ»
ўЫЧ°ЦГCЦРКЗ¶юСх»ҜМјәН№эСх»ҜДЖ·ҙУҰЙъіЙМјЛбДЖәНСхЖшөД·ҙУҰ,·ҙУҰөД»ҜС§·ҪіМКҪОӘЈә2Na2O2+2CO2ЈҪ2Na2CO3+O2Ј»
ўЬa.ЦұҪУ¶БИЎЖшМеМе»эЈ¬І»АдИҙөҪКТОВЈ¬»бК№ИЬТәМе»эФцҙ󣬶БіцҪб№ыІъЙъОуІоЈ¬№КaХэИ·Ј»
b.өчХыБҝНІДЪНвТәГжёЯ¶ИК№Ц®ПаН¬Ј¬К№Ч°ЦГДЪС№ЗҝәННвҪзС№ЗҝПаН¬Ј¬ұЬГв¶БИЎМе»эІъЙъОуІоЈ¬№КbХэИ·Ј»
c.КУПЯУл°јТәГжөДЧоөНөгПаЖҪ¶БИЎБҝНІЦРЛ®өДМе»эКЗХэИ·өД¶БИЎ·Ҫ·ЁЈ¬№КcХэИ·Ј»
№Кҙр°ёОӘЈәabcЈ»
ўЭІв¶ЁіцБҝНІДЪЛ®өДМе»эәу,ХЫЛгіЙұкЧјЧҙҝцПВСхЖшөДМе»эОӘVmLЈ¬ОпЦКөДБҝ=![]() ,ФтСщЖ·ЦР№эСх»ҜДЖөДЦКБҝ·ЦКэОӘ=
,ФтСщЖ·ЦР№эСх»ҜДЖөДЦКБҝ·ЦКэОӘ=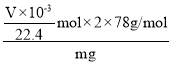 ЎБ100%=
ЎБ100%=![]() %ЎЈ
%ЎЈ