题目内容
13.实验室中,下列除去括号内杂质的有关操作正确的是( )| A. | 苯(硝基苯):加少量蒸馏水振荡,待分层后分液 | |
| B. | CO2(HCl、水蒸气):通过盛有碱石灰的干燥管 | |
| C. | 乙烷(乙烯):通入氢气发生加成反应 | |
| D. | 乙醇(水):加新制的生石灰,蒸馏 |
分析 A.苯和硝基苯都不溶于水;
B.二者都与碱石灰反应;
C.反应在实验室难以完成,且易引入新杂质;
D.水和生石灰反应,乙醇和生石灰不反应.
解答 解:A.苯和硝基苯都不溶于水,二者互溶,应该采用蒸馏方法分离,故A错误;
B.二者都与碱石灰反应,应该用饱和碳酸氢钠溶液除去氯化氢,然后用浓硫酸干燥,故B错误;
C.氢气难以与乙烯反应,且不能确定乙烯的量,易引入了新的杂质氢气,氢气和乙烷无法分离,故C错误;
D.氧化钙可与水反应生成难挥发的氢氧化钙,乙醇和氧化钙不反应,所以可用加生石灰蒸馏的方法分离,故D正确;
故选D.
点评 本题考查物质分离、提纯,明确物质的性质是解本题关键,利用物质性质的差异性选取合适的试剂、分离方法进行除杂、分离,难点是除杂剂的选取,不能引进新的杂质还要考虑操作是否简便,易错选项是C.

练习册系列答案
相关题目
3.铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途.下列关于铝的说法不正确的是( )
| A. | 铝的表面容易形成致密的氧化膜,抗腐蚀性能好 | |
| B. | 常温下不与任何碱反应 | |
| C. | 铝元素在地壳中的含量高,储量丰富 | |
| D. | 工业上可以用电解法冶炼铝 |
4.在容积为2L的密闭容器中,有反应mA(g)+nB(g)?pC(g)+qD(g),经过5min达到平衡,此时各物质的变化为A减少a mol/L,B的平均反应速率v(B)=$\frac{a}{15}$mol/(L•min),C增加$\frac{2a}{3}$( mol/L),这时若增加系统压强,发现A与C的体积分数不变,则m:n:p:q等于( )
| A. | 3:1:2:2 | B. | 1:3:2:2 | C. | 1:3:2:1 | D. | 1:1:1:1 |
1.某羧酸酯A,其分子式为C6H12O2,实验表明酯A和氢氧化钠溶液共热生成B和C,B和盐酸反应生成有机物D,C在铜催化加热条件下氧化为E,其中D、E均能发生银镜反应.由此判断酯A的可能的结构简式有( )
| A. | 6种 | B. | 4种 | C. | 3种 | D. | 2种 |
5.下列有机化合物分子中含有手性碳原子,且与H2发生加成反应后仍含有手性碳原子的是( )
| A. | CH3CH2CHO | B. | OHCCH(OH)CH2OH | ||
| C. | 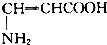 | D. | 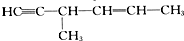 |
2.下列说法或表示法正确的是( )
| A. | 等量的硫蒸气和硫固体分别完全燃烧,前者反应速率快,后者放出热量多 | |
| B. | 由C(石墨)→C(金刚石)△H=+1.9 kJ•mol-1可知,石墨比金刚石稳定 | |
| C. | 在稀溶液中:H++OH-═H2O△H1=-57.3 kJ•mol-1,若含1mol CH3COOH的醋酸溶液与含1 mol NaOH的溶液的反应热为△H2,则△H1>△H2 | |
| D. | 在101 kPa时,10g H2完全燃烧生成液态水,放出1429 kJ热量,氢气燃烧热的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-517.6 kJ•mol-1 |
3.下列有关物品的用途或性质说法错误的是( )
| A. | 纯净的SiO2是现代光学和光纤制品的基本原料,制造光导纤维离不开它 | |
| B. | 硅是良好的半导体材料,也是信息技术的关键材料,制造光电池离不开它 | |
| C. | Cl2的水溶液具有酸性,Cl2通入紫色石蕊溶液中,溶液只变红 | |
| D. | 用坩埚钳夹住一小块铝箔在酒精灯上加热至融化,但融化的铝并不滴落,原因是表面生成了致密的氧化物薄膜 |

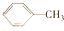 $\stackrel{KMnO_{4}(H)}{→}$
$\stackrel{KMnO_{4}(H)}{→}$
 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$  (苯胺,弱碱性,易氧化)
(苯胺,弱碱性,易氧化) .
. .
. .
.