题目内容
4.亚硝酸钠是一种工业盐,用途广泛;外观与食盐非常相似,但毒性较强.某化学兴趣小组对食盐与亚硝酸钠进行了如下探究:㈠鉴别NaCl和NaNO2
1测定溶液pH
用pH试纸分别测定0.1mol/L两种盐溶液的pH,测得NaNO2溶液呈碱性.NaNO2溶液呈碱性的原因是NO2-+H2O=HNO2+OH-(用离子方程式解释).NaNO2溶液中c(HNO2)=c(OH-)-c(H+)或c(Na+)-c(NO2-)(用溶液中其它离子的浓度关系式表示).
2沉淀法
取2mL0.1mol/L两种盐溶液于试管中,分别滴加几滴稀硝酸银溶液.两支试管均产生白色沉淀.分别滴加几滴稀硝酸并振荡,盛NaNO2溶液的试管中沉淀溶解.该温度下Ksp(AgNO2)=2×10-8; Ksp(AgCl)=1.8×10-10
则反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{100}{9}$(计算结果保留两位小数).
㈡NaNO2性质探究
该兴趣小组同学用如图装置探究亚硝酸钠与硫酸反应产生的气体产物成分.
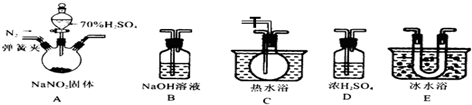
已知:①2NaNO2+H2SO4═Na2SO4+NO↑+NO2↑+H2O
②气体液化的温度:NO2:21℃(液化为暗褐色液体)、NO:-152℃
(1)为了检验装置A中生成的气体产物中的氮氧化物,仪器的连接顺序为(从左向右连接):A→D→E→C→B.
(2)反应前应打开弹簧夹,先通入一段时间氮气.通氮气的目的是排除装置中的空气,防止一氧化氮被氧化.(3)再关闭弹簧夹,打开分液漏斗活塞,滴入70%硫酸后,A中产生红棕色气体.
①如何确认A中产生气体是否含有NO打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO;若无红棕色气体出现,则不含NO.(写出实验操作、现象和结论)
②装置E的作用是冷凝,使NO2完全液化.
③若向C中通入过量O2,则装置B中发生反应的化学方程式为4NO2+O2+4NaOH=4NaNO3+2H2O.
分析 (一)(1)NaNO2溶液显示碱性,NaNO2说明为强碱弱酸盐,亚硝酸根离子水解导致溶液显示碱性;根据亚硝酸钠溶液中的质子守恒或物料守恒分析;
(2)写出该反应的平衡常数表达式,然后根据Ksp(AgNO2)、Ksp(AgCl)进行计算;
(二)(1)根据各部分装置的作用进行连接;
(2)根据装置中含有空气,NO易与空气中氧气反应分析;
(3)①根据一氧化氮和氧气反应生成红棕色二氧化氮气体判断;
②温度低于二氧化氮液化温度时,二氧化氮变成液态;
③氧气过量,进入B中可理解为先生成硝酸,硝酸再与氢氧化钠反应生成硝酸钠和水.
解答 解:(一)(1)由于亚硝酸钠溶液中存在水解平衡:NO2-+H2O=HNO2+OH-,所以亚硝酸钠溶液显示碱性;根据亚硝酸钠溶液中的质子守恒可得:c(OH-)=c(HNO2)+c(H+),则c(HNO2)=c(OH-)-c(H+),根据物料守恒可得:c(HNO2)=c(Na+)-c(NO2-),
故答案为:NO2-+H2O=HNO2+OH-;c(OH-)-c(H+)或c(Na+)-c(NO2-);
(2)反应AgNO2(s)+Cl-(aq)═AgCl(s)+NO2-(aq)的化学平衡常数K=$\frac{c(N{{O}_{2}}^{-})}{c(C{l}^{-})}$,根据Ksp(AgCl)=c(Cl-)•c(Ag+)、Ksp(AgNO2)=c(NO2-)•c(Ag+)可知,K=$\frac{c(N{{O}_{2}}^{-})}{c(C{l}^{-})}$=$\frac{{K}_{sp}(AgN{O}_{2})}{{K}_{sp}(AgCl)}$=$\frac{2×1{0}^{-8}}{1.8×1{0}^{-10}}$=$\frac{100}{9}$,
故答案为:$\frac{100}{9}$;
(二)(1)C吸收水蒸气,B尾气处理,防止污染空气,D检验NO,E冷却二氧化氮,利用检验NO,所以装置的连接为:A→D→E→C→B,
故答案为:D;E;C;B;
(2)反应前应打开弹簧夹,先通入一段时间氮气,排除装置中的空气,防止一氧化氮被氧,
故答案为:防止一氧化氮被氧;
(3)①确认A中产生气体是否含有NO的方法为:打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO;若无红棕色气体出现,则不含NO,
故答案为:打开活塞,向D中通入O2,若出现红棕色气体,证明A中产生气体含有NO;若无红棕色气体出现,则不含NO;
②二氧化氮的液化温度是21℃,低于此温度时,二氧化氮气体变成液态,所以装置E的作用是冷凝使NO2完全液化,
故答案为:冷凝,使NO2完全液化;
③如果向D中通入过量O2,则装置B中二氧化氮、氧气和氢氧化钠反应生成硝酸钠和水,其反应方程式为:4NO2+O2+4NaOH=4NaNO3+2H2O,
故答案为:4NO2+O2+4NaOH=4NaNO3+2H2O.
点评 本题考查性质实验方案的设计与评价,题目难度中等,明确物质的性质和实验原理为解关键,注意实验设计要遵循严密性、可行性、科学性的原则,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用能力.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案| A. | 降低温度将缩短反应达到平衡的时间 | |
| B. | 增大反应体系的压强反应速率一定增大 | |
| C. | 催化剂V2O5同时改变正逆反应速率 | |
| D. | 增加O2的浓度将提高SO2的转化率 |
| A. | 它们的化学性质完全不同 | B. | 它们是碳元素的三种同位素 | ||
| C. | 它们是碳元素的三种单质 | D. | 它们是碳元素的同素异形体 |
| A. | 容器内压强是开始时的1.5倍 | |
| B. | 容器内A、B、C物质的量浓度之比为2:2:1 | |
| C. | 单位时间消耗0.2 mol A 同时生成0.1 mol C | |
| D. | 容器内各物质的浓度不随时间变化 |
| 实验目的 | 操作 | |
| A | 比较水和乙醇中羟基氢的活泼性 | 用金属钠分别与水和乙醇反应 |
| B | 证明HOCH2CHO中含有醛基 | 滴加酸性KMnO4溶液,看紫红色是否褪去 |
| C | 确定磷、砷两元素非金属性的强弱 | 测定同温同浓度的Na3PO4和Na3AsO4水溶液的pH |
| D | 除去苯中混有的苯酚 | 向混合液中加入NaOH溶液,充分反应后,分液 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 10 | B. | 11 | C. | 13 | D. | 15 |
