题目内容
【题目】氰化物在冶金等行业应用广泛,含氰废水的处理显得尤为重要.含氰废水中的氰化物常以[Fe(CN)6]3﹣和CN﹣的形式存在,工业上有多种废水处理方法. 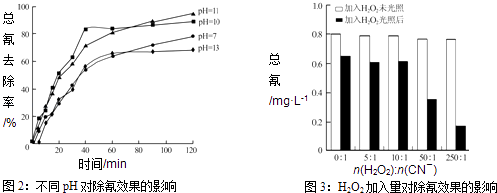
(1)电解处理法 
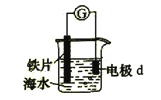
图1电源废水铁电极石墨电极
用图1所示装置处理含CN﹣废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO﹣将CN﹣氧化为无害物质而除去.铁电极为(填“阴极”或“阳极”),阳极产生ClO﹣的电极反应为 .
(2)UV(紫外光线的简称)﹣H2O2氧化法. 实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2 , 置于UV工艺装置中,光照一定时间后取样分析.
【查阅资料】①在强碱性溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O,[Fe(CN)6]4﹣更稳定;
②[Fe(CN)6]3﹣转化为CN﹣容易被H2O2除去;
③HCN是有毒的弱酸,易挥发.
Ⅰ.废水中的CN一经以下反应实现转化:CN一+H2O2+H2O═A+NH3↑,则A是(用符号表示).
Ⅱ.K3[Fe(CN)6]在中性溶液中有微弱水解,用方程式表示水解反应 .
Ⅲ.含氰废水在不同pH下的除氰效果如图2所示,pH选择的最佳范围应为(a.7﹣10;b.10﹣11;c.11﹣13),解释选择该pH范围的原因 .
Ⅳ.图3表示某pH时,加入不同量H2O2 , 处理30min后测定的样品含氰浓度.由图可知:n(H2O2):n(CN﹣)=250:1时,剩余总氰为0.16mgL﹣1 , 除氰率达80%,计算0﹣30min时间段反应速率v(CN﹣)=mgL﹣1min﹣1(结果保留两位有效数字).
【答案】
(1)阴极;2OH﹣+Cl﹣﹣2e﹣═ClO﹣+H2O
(2)HCO3﹣;[Fe(CN)6]3﹣+3H2O?Fe(OH)3+3HCN+3CN﹣;b;碱性适中,有利于[Fe(CN)6]3﹣转变为CN﹣而被氧化;碱性太强,溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O生成[Fe(CN)6]4﹣后难以除去;碱性太弱[Fe(CN)6]3﹣难以水解释放出CN﹣(且水解产生少量HCN有毒);0.021
【解析】解:(1)废水中含CN﹣ , 控制溶液pH为9~10并加入NaCl,阳极产生的ClO﹣将CN﹣氧化,说明溶液中的氯离子在阳极失去电子发生氧化反应,电极反应为:2OH﹣+Cl﹣﹣2e﹣═ClO﹣+H2O,阴极是氢离子得电子产生氢气,铁是活性电极,在装置中只能作阴极,不参加反应,所以答案是:阴极;2OH﹣+Cl﹣﹣2e﹣═ClO﹣+H2O;(2)Ⅰ根据离子反应方程式CN﹣+H2O2+H2O═A+NH3↑可知,N化合价为﹣3价,反应前后不改变,只能是双氧水将C从+2介氧化到+4价,根据电荷守恒和原子守恒,A应是带一个负电荷的阴离子,且包含1个C,1个H,3个O,即HCO3﹣ ,
所以答案是:HCO3﹣;ⅡFe(OH)3是弱碱,HCN是弱酸,则K3[Fe(CN)6]在中性溶液中有Fe3+和CN﹣发生微弱水解,即[Fe(CN)6]3﹣+3H2OFe(OH)3+3HCN+3CN﹣ ,
所以答案是:[Fe(CN)6]3﹣+3H2OFe(OH)3+3HCN+3CN﹣;Ⅲ图2显示,PH在10﹣11时,除氰率超过80%,碱性适中,有利于[Fe(CN)6]3﹣转变为CN﹣而被氧化;碱性太强,溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O生成[Fe(CN)6]4﹣后难以除去;碱性太弱[Fe(CN)6]3﹣难以水解释放出CN﹣(且水解产生少量HCN有毒),
所以答案是:b;碱性适中,有利于[Fe(CN)6]3﹣转变为CN﹣而被氧化;碱性太强,溶液中4[Fe(CN)6]3﹣+4OH﹣═4[Fe(CN)6]4﹣+O2↑+2H2O生成[Fe(CN)6]4﹣后难以除去;碱性太弱[Fe(CN)6]3﹣难以水解释放出CN﹣(且水解产生少量HCN有毒);Ⅳ剩余总氰为0.16mgL﹣1 , 除氰率达80%,则氰的总量为:0.16mgL﹣1÷(1﹣80%)=0.80mgL﹣1 ,
0﹣30分钟氰的改变量为:△c(CN﹣)=0.80mgL﹣1×80%=0.64mgL﹣1 , v(CN﹣)= ![]() =
= ![]() =0.021mgL﹣1min﹣1 ,
=0.021mgL﹣1min﹣1 ,
所以答案是:0.021.

 备战中考寒假系列答案
备战中考寒假系列答案