题目内容
【题目】实验室用下图所示装置制备干燥纯净的氯气,并进行氯气的性质实验,请回答下列问题:
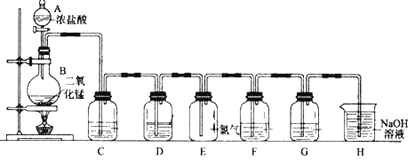
(1)仪器A的名称是____________。
(2)烧瓶中发生反应的化学方程式为(含条件)________________________。
(3)为在E装置中收集到干燥纯净的氯气,装置C中盛放的试剂为_____________(填写名称),作用是____________________________。
(4)F处盛有Na2S溶液,可用置换反应的原理证明氯的非金属性强于硫。反应的离子方程式为 _________________________________________。
(5)G中加入的是淀粉碘化钾溶液,发生反应的现象为_____________________________________。
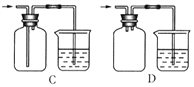
(6)H为尾气处理装置,写出该装置中的离子方程式_________________________。有人认为,用NaOH溶液吸收尾气,可能会引起倒吸。下列装置中,能起到防倒吸作用的是_______(填序号字母)。

【答案】 分液漏斗 MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑ 饱和食盐水(饱和氯化钠溶液) 除去氯气中的氯化氢 Cl2+S2- = 2Cl-+S↓ 溶液变蓝 Cl2+2OH- = Cl-+ClO-+H2O BD
MnCl2+2H2O+Cl2↑ 饱和食盐水(饱和氯化钠溶液) 除去氯气中的氯化氢 Cl2+S2- = 2Cl-+S↓ 溶液变蓝 Cl2+2OH- = Cl-+ClO-+H2O BD
【解析】(1)根据流程图,仪器A为分液漏斗,故答案为:分液漏斗;
(2)烧瓶中浓盐酸与二氧化锰在加热条件下反应生成氯气,反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑,故答案为:MnO2+4HCl(浓)
MnCl2+2H2O+Cl2↑,故答案为:MnO2+4HCl(浓)![]() MnCl2+2H2O+Cl2↑;
MnCl2+2H2O+Cl2↑;
(3)生成的氯气中混有氯化氢和水蒸气,为在E装置中收集到干燥纯净的氯气,装置C中盛放的试剂为饱和食盐水,作用是除去氯气中的氯化氢,故答案为:饱和食盐水;除去氯气中的氯化氢;
(4)F处盛有Na2S溶液,氯气与硫化钠溶液反应生成硫单质沉淀,反应的离子方程式为Cl2+S2- = 2Cl-+S↓,故答案为:Cl2+S2- = 2Cl-+S↓;
(5)G中加入的是淀粉碘化钾溶液,氯气与碘化钾反应生成碘单质,碘遇到淀粉变蓝色,故答案为:溶液变蓝;
(6)H为尾气处理装置,氢氧化钠溶液与氯气反应生成氯化钠和次氯酸钠,反应的离子方程式为Cl2+2OH- = Cl-+ClO-+H2O。B中倒扣的漏斗可以防止倒吸,D在的安全瓶可以防止倒吸,为了防止引起倒吸,可以选用BD装置,故答案为:Cl2+2OH- = Cl-+ClO-+H2O;BD。

 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案

