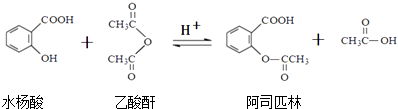
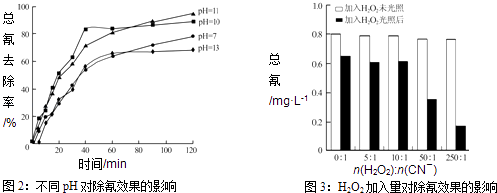
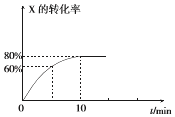
题目内容
【题目】一定温度下,在向冰醋酸(无水醋酸)加水稀释的过程中,溶液的导电能力(I)随着加入水的体积V变化的曲线如图所示.
请回答:
(1)O点导电能力为0的理由是 .
(2)a、b、c三点处,溶液中c(H+)由小到大的顺序为 .
(3)a、b、c三点处,醋酸电离程度最大的是点.
(4)若使c点溶液中的c(CH3COO﹣)提高,下列措施中不可行的是
A.加热
B.加稀盐酸
C.加固体KOH
D.加水
E.加Zn粒
F.加固体CH3COONa
G.加MgO
I.加固体Na2CO3
【答案】
(1)在0点处还未加水,醋酸分子未电离,无自由移动的离子,所以导电能力为0
(2)c<a<b
(3)c
(4)B,D
【解析】解:(1)溶液的导电性与离子浓度有关,离子浓度越大,导电性越强,冰醋酸中没有自由移动的离子,所以冰醋酸不导电,所以答案是:在0点处还未加水,醋酸分子未电离,无自由移动的离子,所以导电能力为0;(2)导电能力越强,离子浓度越大,氢离子浓度越大,则a、b、c三点溶液的氢离子浓度关系为c<a<b,所以答案是:c<a<b;(3)溶液越稀,越促进醋酸电离,则溶液中氢离子的物质的量越大,电离程度越大,所以电离程度最大的是c,所以答案是:c;(4)A.醋酸是弱电解质,电离时需要吸收热量,所以加热促进醋酸电离,导致醋酸根离子浓度最大,故正确; B.加盐酸,抑制醋酸电离,所以醋酸根离子浓度减小,故错误; C.加KOH固体,KOH和醋酸发生中和反应生成醋酸钠,促进醋酸电离,溶液体积不变,醋酸根离子浓度增大,故正确; D.加水促进醋酸电离,但醋酸电离程度远远小于溶液体积增大程度,所以醋酸根离子浓度减小,故错误; E.加入锌粒,锌和氢离子发生置换反应而促进醋酸电离,则醋酸根离子浓度增大,故正确; F.加固体CH3COONa,醋酸钠电离出醋酸根离子导致醋酸根离子浓度增大,故正确; G.加MgO,MgO和氢离子反应而促进醋酸电离,则醋酸根离子浓度增大,故正确; H.加固体Na2CO3 , Na2CO3和氢离子反应而促进醋酸电离,则醋酸根离子浓度增大,故正确,所以答案是:BD.
【考点精析】利用弱电解质在水溶液中的电离平衡对题目进行判断即可得到答案,需要熟知当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.