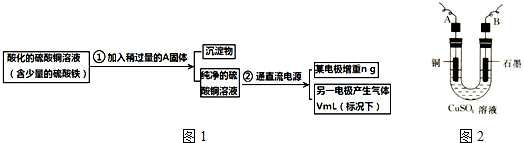
题目内容
4.设NA为阿伏加德罗常数,下列叙述正确的是( )| A. | 3.4gNH3中含有电子数为2NA | |
| B. | 0.1mol/L CuSO4溶液中含有的SO2-4数目为0.1NA | |
| C. | 常温常压下,2.24L O3中含有的氧原子数为0.3NA | |
| D. | 8.7gMnO2与50mL 8mol/L浓盐酸充分反应后,生成Cl2的氯分子数为0.1NA |
分析 A.每个NH3分子中含有10个电子;
B.溶液的体积未知;
C.常温常压,Vm≠22.4L/mol;
D.MnO2只能与浓盐酸反应,一旦盐酸变稀,反应不再发生.
解答 解:A.n(NH3)=$\frac{3.4g}{17g/mol}$=0.2mol,含有的电子的物质的量为0.2mol×10=2mol,则个数为2NA,故A正确;
B.溶液的体积未知,无法计算铜离子的物质的量,故B错误;
C.常温常压,Vm≠22.4L/mol,不能计算臭氧的物质的量,故C错误;
D.MnO2只能与浓盐酸反应,一旦盐酸变稀,反应即停止,故生成Cl2的氯分子数小于0.1NA,故D错误;
故选:A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,注意气体摩尔体积的使用条件和对象,题目难度不大.

练习册系列答案
 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案
相关题目
14.链式炔碳…-C≡C-C≡C-C≡C…是现已发现的碳的第四种同素异形体,已知链式炔碳C300经过适当的处理可得含多个-C≡C-(不含-C≡C-)的链状化合物C300H302,则该分子中含-C≡C-的数目为( )
| A. | 73 | B. | 74 | C. | 75 | D. | 76 |
15.已知某有机物的结构简式如图所示,下列说法不正确的是( )


| A. | 分子式为C15H18 | |
| B. | 能使酸性KMnO4溶液褪色,且是氧化反应 | |
| C. | 1mol该物质最多和2molH2加成 | |
| D. | 苯环上的一氯化物有4种 |
12. 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
 某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )
某温度时,在一个容积为2L的密闭容器中,X,Y,Z三种气体的物质的量随时间的变化曲线如图所示,根据图中数据,下列有关说法错误的是( )| A. | 反应开始至2min,Z的反应速率为0.10mol•L-1•min-1 | |
| B. | 该反应的化学方程式为3X+Y?2Z | |
| C. | 2min时,反应达最大限度,但化学反应仍在进行 | |
| D. | 反应达到平衡时,压强是开始时的0.9倍 |
19.下列有关有机物的说法错误的是( )
| A. | 乙烯、氯乙烯都可通过加聚反应合成塑料 | |
| B. | 油脂、糖和蛋白质都能发生水解反应 | |
| C. | 只用Cu(OH)2:悬浊液就可鉴别乙醇、乙醛和乙酸 | |
| D. | 苯分子中所有的原子都在同一平面上 |
16.将ag镁铁合金投入适量稀硝酸(假设NO是唯一的还原产物,不考虑溶解氧等其它氧化剂)中,当硝酸消耗完时收集到标准状况下2.24L的气体.然后向反应后的溶液中加入3mol•L-1NaOH溶液至金属恰好沉淀完全,沉淀质量为bg,则下列说法不正确的( )
| A. | 若在与硝酸反应后的溶液中再加入Fe,金属可能溶解 | |
| B. | 消耗的氢氧化钠的体积为100mL | |
| C. | b=a+5.1 | |
| D. | a的范围为:3.6<a<5.6 |
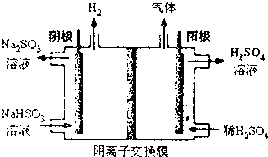 二甲醚(CH3OCH4)是一种重要的清洁燃料,工业上利用水煤气合成二甲醚的三步反应如下:
二甲醚(CH3OCH4)是一种重要的清洁燃料,工业上利用水煤气合成二甲醚的三步反应如下: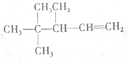 命名3,4,4-三甲基-1-戊烯
命名3,4,4-三甲基-1-戊烯