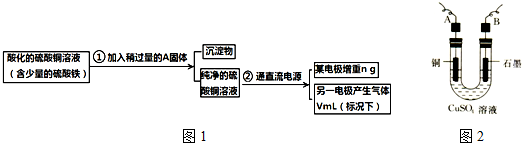
题目内容
5.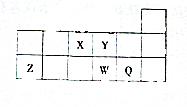 短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示
短周期元素X、Y、Z、W、Q在元素周期表中相对位置如图所示请回答下列问题:
(1)Z代表的元素符号Al,在元素周期表中所处的位置(周期和族)是第三周期第ⅢA族.
(2)上述元素的最高价氧化物对应的水化物酸性最强的酸是HClO4(写化学式)
(3)X的氢化物的电子式为
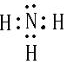 ,其水溶液呈碱性性(填酸、碱或中)
,其水溶液呈碱性性(填酸、碱或中)(4)Q单质与X的氢化物作用,产生无色无味气体和白烟,写出该反应的化学方程式3Cl2+8NH3=6NH4Cl+N2.
分析 由元素在周期表中的位置可知,X为N元素、Y为O元素、Z为Al元素、W为Si元素、Q为Cl元素,结合物质的性质与元素周期律的递变规律解答该题.
解答 解:由元素在周期表中的位置可知,X为N元素、Y为O元素、Z为Al元素、W为Si元素、Q为Cl元素,
(1)Z为Al,位于元素周期表中第三周期第ⅢA族,故答案为:Al;第三周期第ⅢA族;
(2)Cl的最高价氧化物对应的水化物酸性最强,该酸为HClO4,故答案为:HClO4;
(3)X的氢化物为NH3,其电子式为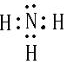 ,水溶液呈碱性,故答案为:
,水溶液呈碱性,故答案为: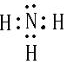 ;碱性;
;碱性;
(4)Q单质与X的氢化物作用,产生无色无味气体和白烟,该反应的化学方程式为3Cl2+8NH3=6NH4Cl+N2,故答案为:3Cl2+8NH3=6NH4Cl+N2.
点评 本题考查位置结构性质关系应用,为高频考点,注意掌握元素周期表的结构和元素周期律的递变规律,题目难度不大.

练习册系列答案
相关题目
15.已知某有机物的结构简式如图所示,下列说法不正确的是( )
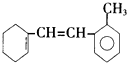
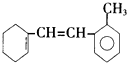
| A. | 分子式为C15H18 | |
| B. | 能使酸性KMnO4溶液褪色,且是氧化反应 | |
| C. | 1mol该物质最多和2molH2加成 | |
| D. | 苯环上的一氯化物有4种 |
16.将ag镁铁合金投入适量稀硝酸(假设NO是唯一的还原产物,不考虑溶解氧等其它氧化剂)中,当硝酸消耗完时收集到标准状况下2.24L的气体.然后向反应后的溶液中加入3mol•L-1NaOH溶液至金属恰好沉淀完全,沉淀质量为bg,则下列说法不正确的( )
| A. | 若在与硝酸反应后的溶液中再加入Fe,金属可能溶解 | |
| B. | 消耗的氢氧化钠的体积为100mL | |
| C. | b=a+5.1 | |
| D. | a的范围为:3.6<a<5.6 |
20.一定条件下,反应4NH3(g)+5O2(g)?4NO(g)+6H2O(g)在密闭容器中进行,反应速率最快的是( )
| A. | v(NH3)=0.0020mol/(L•s) | B. | v(O2)=0.0026mol/(L•s) | ||
| C. | v(NO)=0.0020mol/(L•s) | D. | v(H2O)=0.0028mol/(L•s) |
10.在某酸性溶液中,一定能大量共存的离子组是( )
| A. | Na+、K+、SO42-、HCO3- | B. | NH4+、K+、SO42-、Cl- | ||
| C. | Na+、Al3+、AlO2-、NO3- | D. | Fe2+、K+、S042-、NO3- |
17.500mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0mol/L,用石墨作电极电解此溶液,当通电一段时间后(假设溶液体积不变),两极均收集到22.4L气体(标准状况).下列说法正确的是( )
| A. | 上述电解过程中铜转移2mol电子 | B. | 电解后溶液中c(H+)为4mol/L | ||
| C. | 电解得到的Cu的物质的量为0.5mol | D. | 原混合溶液中c(K+)为1mol/L |
9.下列说法正确的是( )
| A. |  的名称是2,3-二甲基己烷 的名称是2,3-二甲基己烷 | |
| B. | 有机物CH3CO18OH和C2H5OH在浓硫酸催化作用下产物为CH3CO18OC2H5和H2O | |
| C. | 有机物 的一种芳香族同分异构体能发生银镜反应 的一种芳香族同分异构体能发生银镜反应 | |
| D. | 反应 属于加成反应,理论上该反应的原子利用率为100% 属于加成反应,理论上该反应的原子利用率为100% |
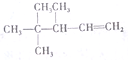 命名3,4,4-三甲基-1-戊烯
命名3,4,4-三甲基-1-戊烯