题目内容
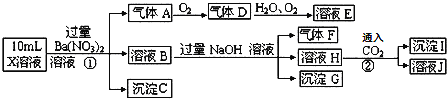
【题目】KMnO4在实验室、生活、科学研究、工业生产中有广泛的应用。已知一种制备KMnO4的实验流程、原理及相关数据如下:

原理:反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知:25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
(1)步骤②的副反应有少量单质气体生成,该反应的化学方程式为___________。
(2)步骤⑤中CO2______(填“能”或“不”能)过量,原因是_____________。
(3)流程中可循环利用的物质主要是_________(写化学式)。
(4)忽略本流程中含锰物质的循环利用,理论上0.3mol MnO2最多得到产品KMnO4的质量为________g。某同学在实验中得到干燥产品的质量多于理论值,排除称量因素,从步骤⑦分析,可能的原因是_______________。
(5)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.5800g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5360g已烘干的Na2C2O4,置于三个不同的洁净锥形瓶中,分别加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。记录实验数据如表
实验次数 | V1(滴定前读数/mL) | V2(滴定后读数/mL) | (V2 -V1)/mL |
1 | 2.65 | 22.67 | 20.02 |
2 | 2.60 | 23.02 | 20.42 |
3 | 2.60 | 22.58 | 19.98 |
已知:2MnO4﹣+ 5C2O42﹣+16H+ =2Mn2++ 10CO/span>2↑+ 8H2O,则KMnO4的纯度为__________(保留四位有效数字);若滴定后俯视滴定管读数,所得KMnO4的纯度将___(填“偏高”或“偏低”或“无影响”)。
【答案】2KClO3![]() 2KCl + 3O2↑ 不能 CO2(过量)+KOH = KHCO3,因生成KHCO3的溶解度比K2CO3的小,可能在KMnO4析出时结晶析出而影响产品的纯度。 MnO2 31.6 蒸发过度,使K2CO3伴随KMnO4析出 80.00% 偏高
2KCl + 3O2↑ 不能 CO2(过量)+KOH = KHCO3,因生成KHCO3的溶解度比K2CO3的小,可能在KMnO4析出时结晶析出而影响产品的纯度。 MnO2 31.6 蒸发过度,使K2CO3伴随KMnO4析出 80.00% 偏高
【解析】
(1)步骤②的副反应有少量单质气体,则可能为KClO3在MnO2的催化作用下发生分解;
(2)从表中数据可以看出,若CO2过量,则会与K2CO3反应生成KHCO3,溶解度小,可能随KMnO4一起结晶析出;
(3)流程中起初投入MnO2,在步骤⑤中又生成MnO2,可循环利用;
(4)从方程式3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O、3K2MnO4+2CO2=2KMnO4
3K2MnO4+KCl+3H2O、3K2MnO4+2CO2=2KMnO4
+MnO2↓+2K2CO3可以看出,0.3mol MnO2最多得到产品0.2mol KMnO4,由此可计算出生成KMnO4的质量;从步骤⑥中加热前混合液的组成,可确定干燥产品的质量多于理论值的原因;
(5)依据反应方程式2MnO4-+ 5C2O42-+16H+=2Mn2++10CO2↑+8H2O,代入数据即可求出KMnO4的纯度;若滴定后俯视滴定管读数,则读取的KMnO4的体积偏小,则所得KMnO4的浓度偏大,可推出纯度的变化。
(1)步骤②的副反应有少量单质气体生成,则可能为KClO3在MnO2的催化作用下发生分解,该反应的化学方程式为2KClO3![]() 2KCl + 3O2↑;
2KCl + 3O2↑;
(2)步骤⑤中CO2不能过量,原因是CO2(过量)+KOH=KHCO3,因生成KHCO3的溶解度比K2CO3的小,可能在KMnO4析出时结晶析出而影响产品的纯度;CO2(过量)+KOH=KHCO3,因生成KHCO3的溶解度比K2CO3的小,可能在KMnO4析出时结晶析出而影响产品的纯度;
(3) )起初投入MnO2,在步骤⑤中又生成MnO2,则流程中可循环利用的物质主要是MnO2;
(4) 从方程式3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O、3K2MnO4+2CO2=2KMnO4
3K2MnO4+KCl+3H2O、3K2MnO4+2CO2=2KMnO4
+MnO2↓+2K2CO3可以看出,0.3mol MnO2最多得到产品0.2mol KMnO4,质量为0.2mol ×158g/mol=31.6g;某同学在实验中得到干燥产品的质量多于理论值,排除称量因素,从步骤⑦分析,可能的原因是蒸发过度,使K2CO3伴随KMnO4析出;
(5)设参加反应的KMnO4的物质的量为x

x=0.0016mol,
则KMnO4的纯度为 =80.00%;若滴定后俯视滴定管读数,则读取的KMnO4的体积偏小,由此计算出的KMnO4的浓度偏大,KMnO4的质量偏大,所得KMnO4的纯度将偏高。
=80.00%;若滴定后俯视滴定管读数,则读取的KMnO4的体积偏小,由此计算出的KMnO4的浓度偏大,KMnO4的质量偏大,所得KMnO4的纯度将偏高。

【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
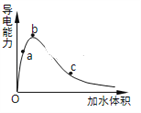
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。