题目内容
【题目】铝土矿(主要含Al2O3、Fe2O3和SiO2等)是工业制备金属铝的主要原料,提取铝的一种工艺流程如图所示,下列说法正确的是( )
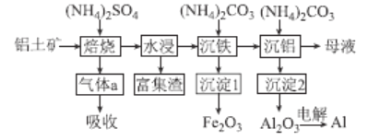
A.焙烧时发生了氧化还原反应
B.气体a最好用NaOH溶液吸收
C.富集渣含有SiO2,沉淀1为Fe2(CO3)3
D.母液可循环再利用或制化肥
【答案】D
【解析】
A.焙烧是加入硫酸铵,硫酸铵属于强酸弱碱盐,显酸性,会将氧化铝转化成铝离子,氧化铁转化为铁离子,没有化合价的变化,不属于氧化还原反应,故A错误;
B.气体a是氨气,最好用硫酸来吸收,故B错误;
C.富集渣含有二氧化硅,Fe2(CO3)3易水解,沉淀1是Fe(OH)3,故C错误;
D.母液中含有大量的硫酸铵,硫酸铵可返回焙烧工序循环使用或制作氮肥,故D正确;
答案选D。

【题目】用中和滴定法测定某烧碱样品的纯度,请回答下列问题:
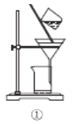
(1)准确称量5.0 g含有少量易溶杂质的样品(杂质不与盐酸反应),配成250 mL待测溶液,用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、___________________。
(2)滴定时,用0.2000 mol·L-1的盐酸来滴定待测溶液,量取待测液10.00 mL应选用_________仪器(填字母)。
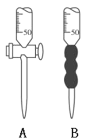
(3)滴定过程中,眼睛应注视___________________________________,以甲基橙做指示剂,正确判断滴定终点的现象是________________________________。
(4)由下表可知,第2次所用盐酸体积明显偏大,其可能的原因是_________。
滴定次数 | 待测溶液体积(mL) | 标准酸体积 | |
滴定前的刻度(mL) | 滴定后的刻度(mL) | ||
第一次 | 10.00 | 0.40 | 20.50 |
第二次 | 10.00 | 2.10 | 24.20 |
第三次 | 10.00 | 4.10 | 24.00 |
a.锥形瓶用待测液润洗
b.滴定过程中锥形瓶中溶液溅出瓶外
c.滴定前滴定管尖嘴有气泡,滴定结束气泡消失
d.滴定结束时,俯视读数
(5)根据表中数据,计算被测烧碱溶液的物质的量浓度是_________,烧碱样品的纯度是_________。
【题目】KMnO4在实验室、生活、科学研究、工业生产中有广泛的应用。已知一种制备KMnO4的实验流程、原理及相关数据如下:

原理:反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知:25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
(1)步骤②的副反应有少量单质气体生成,该反应的化学方程式为___________。
(2)步骤⑤中CO2______(填“能”或“不”能)过量,原因是_____________。
(3)流程中可循环利用的物质主要是_________(写化学式)。
(4)忽略本流程中含锰物质的循环利用,理论上0.3mol MnO2最多得到产品KMnO4的质量为________g。某同学在实验中得到干燥产品的质量多于理论值,排除称量因素,从步骤⑦分析,可能的原因是_______________。
(5)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.5800g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5360g已烘干的Na2C2O4,置于三个不同的洁净锥形瓶中,分别加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。记录实验数据如表
实验次数 | V1(滴定前读数/mL) | V2(滴定后读数/mL) | (V2 -V1)/mL |
1 | 2.65 | 22.67 | 20.02 |
2 | 2.60 | 23.02 | 20.42 |
3 | 2.60 | 22.58 | 19.98 |
已知:2MnO4﹣+ 5C2O42﹣+16H+ =2Mn2++ 10CO/span>2↑+ 8H2O,则KMnO4的纯度为__________(保留四位有效数字);若滴定后俯视滴定管读数,所得KMnO4的纯度将___(填“偏高”或“偏低”或“无影响”)。