题目内容
【题目】用电解乙二醛制备乙二酸(HOOC-COOH)的装置如图所示,通电后,Pt2电极上产生的氯气将乙二醛氧化为乙二酸,下列说法正确的是( )
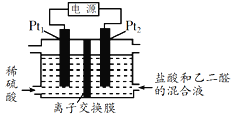
A. Pt2接电源的负极,发生还原反应
B. 电路上每转移1mol电子产生45g乙二酸
C. 盐酸的作用是提供Cl-和增强导电性
D. Pt1极上的电极反应为:2H2O-4e-=== O2↑ + 4H+
【答案】C
【解析】A.根据图示,Pt2为阳极,发生氧化反应,电极反应方程式为OHC-CHO-4e-+2H2O=HOOC-COOH+4H+,故A错误;B.由乙二醛制备乙二酸(HOOC-COOH),生成1mol乙二酸转移4mol电子,因此转移1mol电子产生0.25mol乙二酸,质量为22.5g,故B错误;C.HCl是电解质,其在水溶液中Cl-起提供和增强导电性的作用,故C正确;D.Pt1为阴极得电子发生还原反应,故电极反应方程式为Cl2+2e-═2Cl-,故D错误;故选C。

练习册系列答案
相关题目