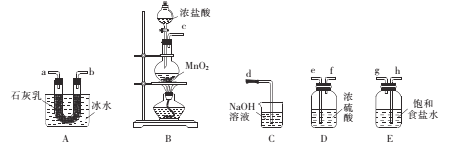
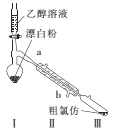
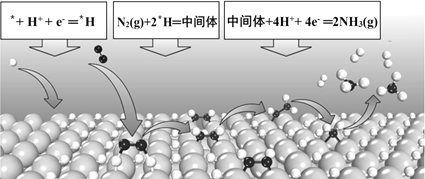
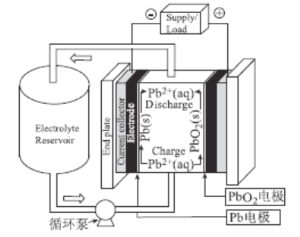
题目内容
【题目】在一个固定容积的密闭容器中,可逆反应:mA(g)+nB(g) ![]() pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是
pC(g)+qD(g)中,当m、n、p、q为任意正整数时,达到平衡的标志是
A.气体分子的平均摩尔质量不再发生变化时B.各组分的物质的量浓度不再改变
C.A与C的质量分数相等D.反应速率vA∶vB∶vC∶vD=m∶n∶p∶q
【答案】B
【解析】
A.反应物及生成物均为气体,则气体的质量一直不变,若m+n=p+q时,气体分子的平均摩尔质量一直不变,则气体平均摩尔质量不能判断是否达到平衡状态,A错误;
B.各组分的物质的量浓度不再改变时,反应达到平衡状态,B正确;
C. A与C的质量分数相等时,不能判断同一物质的正逆反应速率是否相等,不能判断是否达到平衡状态,C错误;
D.反应速率vA∶vB∶vC∶vD=m∶n∶p∶q,不能判断同一物质的正逆反应速率是否相等,不能判断是否达到平衡状态,D错误;
答案为B。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案【题目】KMnO4在实验室、生活、科学研究、工业生产中有广泛的应用。已知一种制备KMnO4的实验流程、原理及相关数据如下:

原理:反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知:25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
(1)步骤②的副反应有少量单质气体生成,该反应的化学方程式为___________。
(2)步骤⑤中CO2______(填“能”或“不”能)过量,原因是_____________。
(3)流程中可循环利用的物质主要是_________(写化学式)。
(4)忽略本流程中含锰物质的循环利用,理论上0.3mol MnO2最多得到产品KMnO4的质量为________g。某同学在实验中得到干燥产品的质量多于理论值,排除称量因素,从步骤⑦分析,可能的原因是_______________。
(5)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.5800g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5360g已烘干的Na2C2O4,置于三个不同的洁净锥形瓶中,分别加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。记录实验数据如表
实验次数 | V1(滴定前读数/mL) | V2(滴定后读数/mL) | (V2 -V1)/mL |
1 | 2.65 | 22.67 | 20.02 |
2 | 2.60 | 23.02 | 20.42 |
3 | 2.60 | 22.58 | 19.98 |
已知:2MnO4﹣+ 5C2O42﹣+16H+ =2Mn2++ 10CO/span>2↑+ 8H2O,则KMnO4的纯度为__________(保留四位有效数字);若滴定后俯视滴定管读数,所得KMnO4的纯度将___(填“偏高”或“偏低”或“无影响”)。