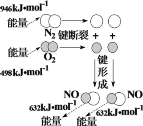题目内容
【题目】某![]() 的X溶液中可能含有
的X溶液中可能含有![]() 、
、![]() ,
,![]() 、
、![]() 、
、![]() 、
、![]() 中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法正确的是
中的若干种,现取X溶液进行连续实验,实验过程及产物如下:下列说法正确的是![]()
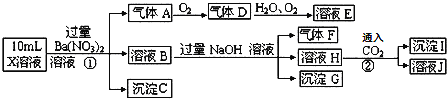
A.气体A是![]()
B.X中肯定存在![]() 、
、![]() 、
、![]() 、
、![]()
C.溶液E和气体F不能发生化学反应
D.X中不能确定的离子是 ![]() 和
和![]()
【答案】D
【解析】
![]() 的溶液显强酸性,而强酸性溶液中一定不会存在
的溶液显强酸性,而强酸性溶液中一定不会存在![]() 离子,加入过量硝酸钡生成沉淀,则该沉淀为
离子,加入过量硝酸钡生成沉淀,则该沉淀为![]() 沉淀,说明溶液中含有
沉淀,说明溶液中含有![]() 离子,生成气体A,A连续氧化生成D和E,则A为NO,D为
离子,生成气体A,A连续氧化生成D和E,则A为NO,D为![]() ,E为
,E为![]() ,说明溶液中含有还原性离子,一定为
,说明溶液中含有还原性离子,一定为![]() 离子;溶液B中加入过量NaOH溶液,生成气体F,则F为
离子;溶液B中加入过量NaOH溶液,生成气体F,则F为![]() ,说明溶液中含有
,说明溶液中含有![]() 离子;H中通入二氧化碳生成了沉淀I,I可能为氢氧化铝或在碳酸钡,故溶液中不一定含有铝离子;由于溶液中已经有
离子;H中通入二氧化碳生成了沉淀I,I可能为氢氧化铝或在碳酸钡,故溶液中不一定含有铝离子;由于溶液中已经有![]() ,故C
,故C![]() 可有可无,不能确定。故溶液中一定存在:
可有可无,不能确定。故溶液中一定存在:![]() 、
、![]() 、
、![]() 、
、![]() ;一定不存在:
;一定不存在:![]() ;不能确定的是:
;不能确定的是:![]() 、
、![]() 。
。
A.气体A为NO,故A错误;
B.依据分析可知:溶液中一定存在:![]() 、
、![]() 、
、![]() ,
,![]() 存在不能确定,故B错误;
存在不能确定,故B错误;
C.溶液E为![]() ,气体F为
,气体F为![]() ,二者能反应生成硝酸铵,故C错误;
,二者能反应生成硝酸铵,故C错误;
D.![]() 和
和![]() 不能确定,故D正确;
不能确定,故D正确;
故选D。

【题目】下列示意图与化学用语表述内容不相符的是(水合离子用相应离子符号表示)
A | B | C | D |
|
|
|
|
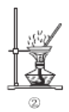
NaCl溶于水 | 铁的吸氧腐蚀原理 | 铜锌原电池构造和原理 | N2与O2反应能量变化 |
NaCl=Na+ + Cl- | 负极:Fe - 2e-=Fe2+ | 总反应:Zn + Cu2+=Zn2+ + Cu | N2(g) + O2(g)=2NO(g)ΔH=-180 kJ·mol-1 |
A.AB.BC.CD.D
【题目】KMnO4在实验室、生活、科学研究、工业生产中有广泛的应用。已知一种制备KMnO4的实验流程、原理及相关数据如下:

原理:反应I:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
反应Ⅱ:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
(墨绿色) (紫红色)
已知:25℃物质的溶解度g/100g水
K2CO3 | KHCO3 | KMnO4 |
111 | 33.7 | 6.34 |
(1)步骤②的副反应有少量单质气体生成,该反应的化学方程式为___________。
(2)步骤⑤中CO2______(填“能”或“不”能)过量,原因是_____________。
(3)流程中可循环利用的物质主要是_________(写化学式)。
(4)忽略本流程中含锰物质的循环利用,理论上0.3mol MnO2最多得到产品KMnO4的质量为________g。某同学在实验中得到干燥产品的质量多于理论值,排除称量因素,从步骤⑦分析,可能的原因是_______________。
(5)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ.称取1.5800g高锰酸钾产品,配成100mL溶液
Ⅱ.准确称取三份0.5360g已烘干的Na2C2O4,置于三个不同的洁净锥形瓶中,分别加入少量蒸馏水使其溶解,再加入少量硫酸酸化;
Ⅲ.锥形瓶中溶液加热到75~80℃,趁热用I中配制的高锰酸钾溶液滴定至终点。记录实验数据如表
实验次数 | V1(滴定前读数/mL) | V2(滴定后读数/mL) | (V2 -V1)/mL |
1 | 2.65 | 22.67 | 20.02 |
2 | 2.60 | 23.02 | 20.42 |
3 | 2.60 | 22.58 | 19.98 |
已知:2MnO4﹣+ 5C2O42﹣+16H+ =2Mn2++ 10CO/span>2↑+ 8H2O,则KMnO4的纯度为__________(保留四位有效数字);若滴定后俯视滴定管读数,所得KMnO4的纯度将___(填“偏高”或“偏低”或“无影响”)。