题目内容
【题目】新型材料纳米级铁粉与普通铁粉具有不同的性质.已知:在不同温度下,纳米级铁粉与水蒸气反应的固体产物不同,温度低于570℃时,生成FeO;高于570℃时,生成Fe3O4 .
(1)写出温度低于570℃时反应的化学方程式 .
(2)中学教材中用如图所示实验装置,完成铁粉与水蒸气反应的演示实验.实验中使用肥皂液的作用是 .
(3)乙同学为了探究实验后的固体产物是否存在Fe3O4(假定铁全部反应完全)设计下列实验方案: ①取固体样品m1g,溶于足量的稀盐酸;
②向①反应后的溶液中加入足量H2O2得溶液X再加氨水,充分反应后,过滤、洗涤、干燥;
③将②中所得固体进行灼烧,得到红棕色固体m2g.
溶液X中发生氧化还原反应的离子方程式为;m1与m2符合关系时,才能确定固体样品中一定只存在Fe3O4 . 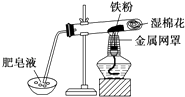
【答案】
(1)Fe+H2O(g) ![]() ?FeO+H2
?FeO+H2
(2)检验反应中生成的H2
(3)2Fe2++2H++H2O2=2Fe3++2H2O; ![]() =0.97
=0.97
【解析】解:(1)纳米级铁粉与水蒸气反应,温度低于570℃时,生成FeO,反应的化学方程式为:Fe+H2O(g) ![]() FeO+H2,
FeO+H2,
所以答案是:Fe+H2O(g) ![]() FeO+H2;(2)使用肥皂液的作用是检验反应中生成的H2,反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声时,说明“铁与水蒸气”能够进行反应,所以答案是:检验反应中生成的H2;(3)双氧水可将二价铁离子氧化为三价铁离子,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
FeO+H2;(2)使用肥皂液的作用是检验反应中生成的H2,反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声时,说明“铁与水蒸气”能够进行反应,所以答案是:检验反应中生成的H2;(3)双氧水可将二价铁离子氧化为三价铁离子,离子方程式为:2Fe2++2H++H2O2=2Fe3++2H2O,
固体样品m1克与红棕色固体m2克所含铁元素的物质的量相同,假设全部是FeO,
2FeO~ | Fe2O3 |
144g | 160 |
m1与m2之比= ![]() =0.9;
=0.9;
假设全部是Fe3O4,
2Fe3O4~ | 3Fe2O3 |
464g | 480g |
m1与m2之比为: ![]() =
= ![]() =0.97,
=0.97,
m1与m2之比最少应大于 0.97时,固体样品中一定存在Fe3O4,
所以答案是:2Fe2++2H++H2O2=2Fe3++2H2O; ![]() =0.97.
=0.97.