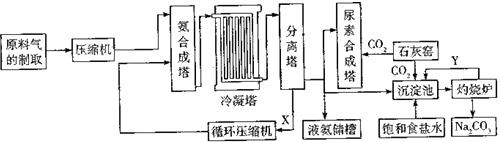
��Ŀ����
����Ŀ��ij������ˮ��Һ�п��ܺ������������е������֣�Na+��Al3+��Fe3+��Mg2+��Ba2+��NH4+��Cl����SO42�� �� �ֱַ�ȡ100mL��������Һ��������ʵ�飮 �ٵ�һ�ݼӹ���NaOH��Һ����ȣ��ռ���0.01mol���壬�������ɣ�ͬʱ�õ���Һ�ף�
�������Һ��ͨ�����CO2 �� ���ɰ�ɫ���������������ˡ�ϴ�ӡ����պõ�1.02g���壮
�۵ڶ��ݼ�����BaCl2��Һ�����ɰ�ɫ���������˺�ij�������������ϴ�ӡ�����õ�11.65g���壬����Һ�м���AgNO3��Һ���а�ɫ���������������й�������ȷ���ǣ�������
A.�ɢٿ�֪ԭ��Һ��������ΪNH4+ �� ��Ũ��Ϊ0.01mol/L
B.ԭ��Һһ������Cl��
C.ԭ��Һ�϶�û��Fe3+��Mg2+ �� һ������Na+
D.n��NH4+����n��Al3+����n��SO42����=1��1��5
���𰸡�C
���������⣺������������֪��һ����Al3+��NH4+��SO42����һ������Fe3+��Mg2+��Ba2+���ɵ���غ��֪0.05��2��0.01��1+0.02��3����һ����Na+������ȷ���Ƿ�Cl����
A���ɢٿ�֪ԭ��Һ��������ΪNH4+����Ũ��Ϊ ![]() =0.1mol/L����A����
=0.1mol/L����A����
B������������������ȷ���Ƿ�Cl������B����
C��������������֪��ԭ��Һ�϶�û��Fe3+��Mg2+��һ������Na+����C��ȷ��
D��n��NH4+����n��Al3+����n��SO42����=0.01mol��0.02mol��0.05mol=1��2��5����D����
��ѡC��
�ٵ�һ�ݼӹ���NaOH��Һ����ȣ��ռ���0.01mol���壬�������ɣ�0.01mol����Ϊ��������Һ��һ������NH4+�������ʵ���Ϊ0.01mol��������˵��ԭ��Һ����Fe3+��Mg2+��ͬʱ�õ���Һ�ף�
�������Һ��ͨ�����CO2�����ɰ�ɫ���������������ˡ�ϴ�ӡ����պõ�1.02g���壬˵������Al3+��1.02gΪ��������n��Al3+��= ![]() ��2=0.02mol��
��2=0.02mol��
�۵ڶ��ݼ�����BaCl2��Һ�����ɰ�ɫ���������˺�ij�������������ϴ�ӡ�����õ�11.65g���壬����Ϊ���ᱵ��˵��ԭ��Һ����SO42����һ��������Ba2+��n��SO42����= ![]() =0.05mol������Һ�м���AgNO3��Һ���а�ɫ��������������ȷ����Һ���Ƿ����Cl������ϵ���غ��ж��Ƿ������ӣ��Դ������
=0.05mol������Һ�м���AgNO3��Һ���а�ɫ��������������ȷ����Һ���Ƿ����Cl������ϵ���غ��ж��Ƿ������ӣ��Դ������