题目内容
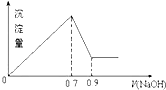
【题目】室温下,用相同浓度的NaOH溶液,分别滴定浓度均为0.1mol/L的三种酸(HA、HB和HD)溶液,滴定的曲线如图所示,下列判断正确的是( ) 
A.三种酸的电离常数关系:KHA>KHB>KHD
B.滴定至P点时,溶液中:c(Na+)>c(B﹣)>c(HB)>c(H+)>c(OH﹣)
C.pH=7时,三种溶液中:c(A﹣)=c(B﹣)=c(D﹣)
D.当中和百分数达100%时,将三种溶液混合后:c(HA)+c(HB)+c(HD)=c(OH﹣)
【答案】A
【解析】解:A.相同物质的量浓度的一元酸,酸的pH越小,氢离子浓度越大,说明酸的电离程度越大,则该酸的酸性越强,其电离平衡常数越大,根据图知,未加NaOH溶液时,pH:HA<HB<HD,说明酸的电离程度HA>HB>HD,则KHA>KHB>KHD , 故A正确;B.中和50%即P点,溶液中溶质为等物质的量浓度的酸(HB)和盐(NaB),由图可知溶液呈酸性,则c(H+)>c(OH﹣),且酸的电离程度大于酸根离子水解程度,
①NaB完全电离:NaB=Na++B﹣ , 这一步的c(B﹣)=c(Na+),
②HB少部分电离:HBH++B﹣ , 则c(HB)>c(H+),
③NaB少部分水解:B﹣+H2OHB+OH﹣ ,
由于酸的电离程度大于盐的水解程度,则HB电离产生的B﹣相对NaB水解消耗的B﹣多,所以c(B﹣)>c(Na+),由于HB电离消耗得多,水解生成的HB少,
所以c(Na+)>c(HB),则c(B﹣)>c(Na+)>c(HB)>c(H+)>c(OH﹣),故B错误;
C.当pH=7时,根据电荷守恒三种溶液中离子浓度关系为:
c(Na+)+c(H+)=c(A﹣)+c(OH﹣),由于c(H+)=c(OH﹣),所以c(Na+)=c(A﹣),
c(Na+)+c(H+)=c(B﹣)+c(OH﹣),由于c(H+)=c(OH﹣),所以c(Na+)=c(B﹣),
c(Na+)+c(H+)=c(D﹣)+c(OH﹣),由于c(H+)=c(OH﹣),所以c(Na+)=c(D﹣),
由于三种酸根的水解程度不同,则溶液呈中性时所消耗的氢氧化钠的体积不相同,则三种溶液中钠离子浓度不同,c(A﹣)、c(B﹣)、c(D﹣)也不同,故C错误;
D.恰好中和时,三种溶液所消耗的氢氧化钠体积相同,生成三种盐的浓度相同,混合后溶液因盐的水解呈碱性,质子守恒的关系为:c(OH﹣)=c(HA)+c(HB)+c(HD)+c(H+),故D错误;
故选:A.
A.根据等浓度的三种一元酸的PH大小确定三种酸的电离常数;
B.HB被中和一半时,溶液中溶质有中和生成的盐与未反应完的酸,根据盐的水解与酸的电离程度进行比较;
C.当PH=7时,三种溶液所消耗的氢氧化钠的体积不相同;
D.恰好中和时,三种溶液所消耗的氢氧化钠体积相同,生成三种盐的浓度相同,混合后根据盐的水解写出质子守恒解答.

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】如表是A、B、C、D、E五种有机物的有关信息:
A | ①能使溴的四氯化碳溶液褪色; |
B | ①由C、H两种元素组成; |
C | ①由C、H、O三种元素组成; |
D | ①相对分子质量比C少2; |
E | ①由C、H、O三种元素组成; |
根据表中信息回答下列问题:
(1)A与溴的四氯化碳溶液反应的生成物的名称叫做;写出在一定条件下,A生成高分子化合物的化学反应方程式 .
(2)A与氢气发生加成反应后生成分子F,与F在分子组成和结构上相似的有机物有一大类(俗称“同系物”),它们均符合通式CnH2n+2 . 当n=时,这类有机物开始出现同分异构体.
(3)B具有的性质是(填序号):①无色无味液体、②有毒、③不溶于水、④密度比水大、⑤与KMnO4酸性溶液和溴水反应褪色、⑥任何条件下不与氢气反应;写出在浓硫酸作用下,B与浓硝酸反应的化学方程式: .
(4)C与E反应生成相对分子质量为100的酯,该反应类型为;其化学反应方程式为 .
(5)写出由C氧化生成D的化学反应方程式: .