题目内容
15. (1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)
(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,其结果偏小.(填“偏大”、“偏小”、或“不变”)(2)从石油中分离出汽油、煤油和柴油等,所采用的方法是分馏.(填“干馏”或“分馏”)
(3)除去二氧化碳气体中的氯化氢杂质,选用的试剂是饱和NaHCO3溶液.(填“NaOH溶液”或“饱和NaHCO3溶液”)
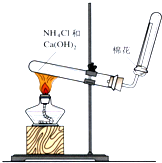
(4)如图是实验室制取氨气的装置,回答下列问题:
①收集氨气的方法是向下排空气法.
②验证氨气是否收集满的方法是用湿润的红色石蕊试纸靠近塞棉花的试管口,若试纸变蓝色,说明收集满.(写一种)
分析 (1)根据c=$\frac{n}{V}$并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
(2)从石油中分离出汽油、煤油和柴油等的操作为石油的分馏;
(3)根据CO2与饱和NaHCO3溶液不反应,而HCl能与饱和NaHCO3溶液生成CO2来分析;
(4)①氨气的密度比空气的小;
②根据氨气是唯一的碱性气体来分析.
解答 解:(1)配制0.5mol/L的NaOH溶液,定容时向容量瓶中加蒸馏水超过刻度线,会导致溶液体积偏大,则浓度偏小,故答案为:偏小;
(2)根据石油中各组分的沸点不同从石油中分离出汽油、煤油和柴油等的操作为石油的分馏,故答案为:分馏;
(3)CO2和HCl均为酸性气体,均能与NaOH溶液反应,而CO2与饱和NaHCO3溶液不反应,而HCl能与饱和NaHCO3溶液生成CO2,故除去二氧化碳气体中的氯化氢杂质,选用的试剂是饱和NaHCO3溶液,故答案为:饱和NaHCO3溶液;
(4)①氨气的密度比空气的小,故采用向下排空气法,故答案为:向下;
②氨气是唯一的碱性气体,故只要能证明有碱性气体逸出,则氨气已集满,故方法为用湿润的红色石蕊试纸靠近塞棉花的试管口,若试纸变蓝色,说明收集满,故答案为:用湿润的红色石蕊试纸靠近塞棉花的试管口,若试纸变蓝色,说明收集满.
点评 本题考查了配制溶液时的误差分析以及气体的除杂,应注意的是CO2与饱和NaHCO3溶液不反应,而HCl能与饱和NaHCO3溶液生成CO2,故除去二氧化碳气体中的氯化氢杂质,选用的试剂是饱和NaHCO3溶液.

练习册系列答案
 智慧小复习系列答案
智慧小复习系列答案
相关题目
6.有分子式为C10H20O2的酯A,在酸性条件下水解生成有机物C和D,且C在一定条件下可转化成D,则A的可能结构有( )
| A. | 4种 | B. | 8种 | C. | 16种 | D. | 40种 |
3.下列物质,既能与盐酸反应又能与氢氧化钠溶液反应的是( )
| A. | AlCl3 | B. | Al(OH)3 | C. | KOH | D. | HCl |
10.对于反应2H2O2═2H2O+O2↑,下列措施能加快该反应速率的是( )
| A. | 减小压强 | B. | 加热 | C. | 加水稀释 | D. | 降低温度 |
7.为了探究影响化学反应速率的因素,4位同学分别设计了下列4个实验,其中结论不正确的是( )
| A. | 将大小、形状相同的镁条和铝条与相同浓度、相同温度下的盐酸反应时,两者快慢相同 | |
| B. | 盛有相同浓度双氧水的两支试管,一支加入MnO2放在冷水中,一支直接放在冷水中,前者反应快 | |
| C. | 将浓硝酸分别放在冷暗处和强光下,发现强光下的浓硝酸分解得快 | |
| D. | 升高温度,H2O2的分解速率加快,原因是反应物分子的能量增加,活化分子百分数增大,有效碰撞次数增多 |
 NH3•H2ONH3•H2O
NH3•H2ONH3•H2O NH4++OH-
NH4++OH-
 ;
;
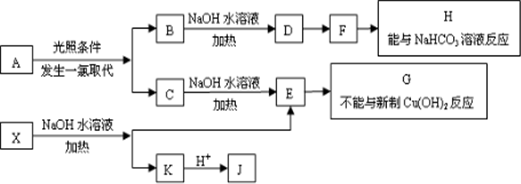
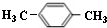 .
.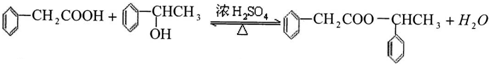 ;该反应类型是酯化反应(或取代反应).
;该反应类型是酯化反应(或取代反应).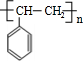 .
.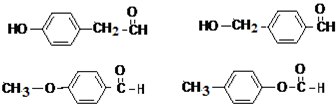 任意一种.
任意一种.