题目内容
A、B、C、D、E、F为原子序数依次增大的六种元素,其中除F外均为短周期主族元素.常温下A、B、C的常见单质均为无色、无味的气体,D、E、F的单质均为固体,且F单质是目前世界上使用量最大的金属.A是所有元素中原子半径最小的元素,C与E同主族,且E的原子序数为C的2倍,D的最外层电子数比最内层多1个.请用化学用语回答下列问题:
(1)C的离子结构示意图为______;D与E两元素的离子半径:D______E(填“>”、“<”或“=”).
(2)由A与碳元素组成的原子个数比3:1的最简化合物的结构简式为______.
(3)A与C形成的10电子阴离子与A与E形成的18电子阴离子反应的离子方程式为______.
(4)B的最高价氧化物的水化物与其氢化物反应生成的盐的水溶液的PH______7(填“>”、“<”或“=”).化合物AB3是一种无色的液态物质,受撞击会分解成两种单质,请写出该反应的化学方程式______.
(5)已知一定条件下,D单质与氧化物F3O4反应时,放出大量的热且使F单质熔化.试写出该反应的化学方程式______.
(6)上述元素中的五种元素可形成一种复盐,三种离子个数比为1:1:2,若向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出;若加入盐酸酸化的BaCl2溶液,也有白色沉淀产生.则该复盐的化学式为______.
解:常温下A、B、C的单质均为无色、无味的气体,常见单质均为无色无味的气体有H2、N2、O2;F单质是目前世界上使用量最大的金属,说明F为铁;A是所有元素中原子半径最小的元素,说明A是氢元素;C与E同主族,且E的原子序数为C的2倍,在主族中只有氧和硫,氧的原子序数为8,硫的原子序数为16;D的最外层电子数比最内层多1个,A、B、C、D、E、F为原子序数依次增大的六种元素,C为氧,说明D在第三周期,则D原子的核外有三个电子层,第一电子层排2个电子,最外层即第三层应排3个电子,则核外电子数为13,即为铝.故A为H、B为N、C为O、D为Al、E为S、F为Fe.
(1)氧原子最外层排布6个电子,得到两个电子后形成O2-,O2-离子结构示意图为 .微粒半径大小比较看电子层数,电子层数越多,半径越大,D离子是Al3+与E离子是S2-,Al3+离子结构示意图为
.微粒半径大小比较看电子层数,电子层数越多,半径越大,D离子是Al3+与E离子是S2-,Al3+离子结构示意图为 ,S2-离子结构示意图为
,S2-离子结构示意图为 ,Al3+核外2个电子层,S2-核外3个电子层,故离子半径:Al3+<S2-,
,Al3+核外2个电子层,S2-核外3个电子层,故离子半径:Al3+<S2-,
故答案为: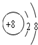 ;<;
;<;
(2)A是氢元素,由H与碳元素组成的原子个数比3:1的化合物的最简式为CH3,再结合烷烃通式:CnH2n+2分析:
设该化合物的分子式为(CH3)n,n=1,分子式为CH3,不符合烷烃通式;n=2,分子式为C2H6,为乙烷,符合烷烃通式;n=3,分子式为C3H9,不符合烷烃通式;故可确定该化合物为乙烷C2H6,结构简式为CH3-CH3.
故答案为:CH3-CH3;
(3)H与O形成的10电子阴离子是OH-,H与S形成的18电子阴离子是HS-,HS-是酸式根离子,可与OH-反应,反应的离子方程式为HS-+OH-═S2-+H2O,
故答案为:HS-+OH-═S2-+H2O;
(4)B是N元素,氮的最高价氧化物的水化物是HNO3,氮的氢化物是NH3,HNO3与NH3反应生成的盐是NH4NO3,为强酸弱碱盐.根据盐类水解原理解题,强酸弱碱盐水解呈酸性,所以NH4NO3水溶液呈酸性,pH<7.
化合物AB3是HN3,根据题意,受撞击会分解成两种单质,只能是H2和N2.根据反应物和生成物写出方程式再配平即得2HN3═H2↑+3N2↑,
故答案为:<;2HN3=H2↑+3N2↑;
(5)D单质是Al,与氧化物F3O4反应时,放出大量的热且使Fe单质熔化,该反应为铝热反应,根据反应物和生成物写出方程式再配平即得8Al+3Fe3O4 4Al2O3+9Fe,
4Al2O3+9Fe,
故答案为:8Al+3Fe3O4 4Al2O3+9Fe;
4Al2O3+9Fe;
(6)复盐指由两种阳离子和一种酸根离子组成的盐,向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解,说明含有Al3+,反应为Al3++3OH-═Al(OH)3↓、
Al(OH)3+OH-═AlO2-+2H2O.同时有刺激性气味的气体放出,说明含有NH4+,反应为NH4++OH-═NH3?H2O.加入盐酸酸化的BaCl2溶液,也有白色沉淀产生,说明酸根离子是SO42-,反应为
SO42-+Ba2+═BaSO4↓.故该复盐中含NH4+、Al3+、SO42-.根据三种离子个数比为1:1:2,结合化合价代数和等于零即可确定该复盐的化学式为NH4Al(SO4)2,
故答案为:NH4Al(SO4)2.
分析:(1)常温下A、B、C的常见单质均为无色、无味的气体,常见单质均为无色无味的气体有H2、N2、O2;且F单质是目前世界上使用量最大的金属,说明F为铁;A是所有元素中原子半径最小的元素,说明A是氢元素;C与E同主族,且E的原子序数为C的2倍,在主族中只有氧和硫;D的最外层电子数比最内层多1个,可说明最外层电子数为3,即为铝;
(2)根据烷烃通式:CnH2n+2,结合原子个数比3:1确定最简式,然后确定结构简式;
(3)电子总数为10个电子的微粒有:分子:CH4、NH3、H2O、HF、Ne; 阴离子:N3-、O2-、F-、OH-、NH2-; 阳离子:Na+、Mg2+、Al3+、NH4+、H3O+.
电子总数为18个电子的微粒有:SiH4、PH3、H2S、HCl、Ar、CH3-CH3、NH2-NH2、HO-OH、CH3-OH、H2N-OH、F2;阴离子:S2-、O22-、Cl-、HS-; 阳离子:K+、Ca2+、N2H5+、N2H62+;
(4)根据盐类水解原理解题,强酸弱碱盐水解呈酸性,强碱弱酸盐水解呈碱性;
(5)根据铝热反应确定反应物和生成物,写出方程式;
(6)复盐指由两种阳离子和一种酸根离子组成的盐,向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出,说明阳离子是Al3+和
NH4+,加入盐酸酸化的BaCl2溶液,也有白色沉淀产生,说明酸根离子是SO42-,即可确定该复盐的组成.
点评:本题侧重元素周期表的推断,结合元素化合物的性质,采用定量分析等方法解题,解题的关键在于利用元素周期表和元素化合物性质相结合推断出各元素.
(1)氧原子最外层排布6个电子,得到两个电子后形成O2-,O2-离子结构示意图为
 .微粒半径大小比较看电子层数,电子层数越多,半径越大,D离子是Al3+与E离子是S2-,Al3+离子结构示意图为
.微粒半径大小比较看电子层数,电子层数越多,半径越大,D离子是Al3+与E离子是S2-,Al3+离子结构示意图为 ,S2-离子结构示意图为
,S2-离子结构示意图为 ,Al3+核外2个电子层,S2-核外3个电子层,故离子半径:Al3+<S2-,
,Al3+核外2个电子层,S2-核外3个电子层,故离子半径:Al3+<S2-,故答案为:
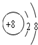 ;<;
;<;(2)A是氢元素,由H与碳元素组成的原子个数比3:1的化合物的最简式为CH3,再结合烷烃通式:CnH2n+2分析:
设该化合物的分子式为(CH3)n,n=1,分子式为CH3,不符合烷烃通式;n=2,分子式为C2H6,为乙烷,符合烷烃通式;n=3,分子式为C3H9,不符合烷烃通式;故可确定该化合物为乙烷C2H6,结构简式为CH3-CH3.
故答案为:CH3-CH3;
(3)H与O形成的10电子阴离子是OH-,H与S形成的18电子阴离子是HS-,HS-是酸式根离子,可与OH-反应,反应的离子方程式为HS-+OH-═S2-+H2O,
故答案为:HS-+OH-═S2-+H2O;
(4)B是N元素,氮的最高价氧化物的水化物是HNO3,氮的氢化物是NH3,HNO3与NH3反应生成的盐是NH4NO3,为强酸弱碱盐.根据盐类水解原理解题,强酸弱碱盐水解呈酸性,所以NH4NO3水溶液呈酸性,pH<7.
化合物AB3是HN3,根据题意,受撞击会分解成两种单质,只能是H2和N2.根据反应物和生成物写出方程式再配平即得2HN3═H2↑+3N2↑,
故答案为:<;2HN3=H2↑+3N2↑;
(5)D单质是Al,与氧化物F3O4反应时,放出大量的热且使Fe单质熔化,该反应为铝热反应,根据反应物和生成物写出方程式再配平即得8Al+3Fe3O4
 4Al2O3+9Fe,
4Al2O3+9Fe,故答案为:8Al+3Fe3O4
 4Al2O3+9Fe;
4Al2O3+9Fe;(6)复盐指由两种阳离子和一种酸根离子组成的盐,向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解,说明含有Al3+,反应为Al3++3OH-═Al(OH)3↓、
Al(OH)3+OH-═AlO2-+2H2O.同时有刺激性气味的气体放出,说明含有NH4+,反应为NH4++OH-═NH3?H2O.加入盐酸酸化的BaCl2溶液,也有白色沉淀产生,说明酸根离子是SO42-,反应为
SO42-+Ba2+═BaSO4↓.故该复盐中含NH4+、Al3+、SO42-.根据三种离子个数比为1:1:2,结合化合价代数和等于零即可确定该复盐的化学式为NH4Al(SO4)2,
故答案为:NH4Al(SO4)2.
分析:(1)常温下A、B、C的常见单质均为无色、无味的气体,常见单质均为无色无味的气体有H2、N2、O2;且F单质是目前世界上使用量最大的金属,说明F为铁;A是所有元素中原子半径最小的元素,说明A是氢元素;C与E同主族,且E的原子序数为C的2倍,在主族中只有氧和硫;D的最外层电子数比最内层多1个,可说明最外层电子数为3,即为铝;
(2)根据烷烃通式:CnH2n+2,结合原子个数比3:1确定最简式,然后确定结构简式;
(3)电子总数为10个电子的微粒有:分子:CH4、NH3、H2O、HF、Ne; 阴离子:N3-、O2-、F-、OH-、NH2-; 阳离子:Na+、Mg2+、Al3+、NH4+、H3O+.
电子总数为18个电子的微粒有:SiH4、PH3、H2S、HCl、Ar、CH3-CH3、NH2-NH2、HO-OH、CH3-OH、H2N-OH、F2;阴离子:S2-、O22-、Cl-、HS-; 阳离子:K+、Ca2+、N2H5+、N2H62+;
(4)根据盐类水解原理解题,强酸弱碱盐水解呈酸性,强碱弱酸盐水解呈碱性;
(5)根据铝热反应确定反应物和生成物,写出方程式;
(6)复盐指由两种阳离子和一种酸根离子组成的盐,向该盐溶液中逐滴加入浓NaOH溶液时,先产生白色沉淀,后沉淀逐渐溶解;同时有刺激性气味的气体放出,说明阳离子是Al3+和
NH4+,加入盐酸酸化的BaCl2溶液,也有白色沉淀产生,说明酸根离子是SO42-,即可确定该复盐的组成.
点评:本题侧重元素周期表的推断,结合元素化合物的性质,采用定量分析等方法解题,解题的关键在于利用元素周期表和元素化合物性质相结合推断出各元素.

练习册系列答案
相关题目
 [化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.
[化学/选修/物质结构与性质]A、B、C、D、E五种短周期元素,原子序数依次增大,各元素对应的单质均为固体.A、C、E三元素的原子核外均只有2个未成对电子.B、E元素的原子序数之和等于C、D元素的原子序数之和.