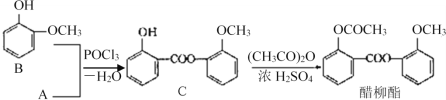
题目内容
【题目】氮及其化合物有许多用途。回答下列问题:
(1)基态![]() 原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
原子的电子排布式为________,锰的第三电离能比铁的第三电离能大,这是因为________________________________________________________。
(2)![]() 的沸点(71℃)比
的沸点(71℃)比![]() 的沸点(25.7℃)高,主要原因是______________________。
的沸点(25.7℃)高,主要原因是______________________。
(3)根据价层电子对互斥理论,![]() 、
、![]() 、
、![]() 三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
三种微粒中,中心原子价层电子对数不同于其他微粒的是_______。
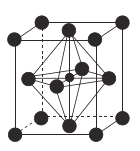
(4)![]() (氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为
(氮化锰)的晶胞结构如图所示,晶胞参数为0.3851nm。该氮化锰的密度为![]() (列出计算式)。________________________________________________________
(列出计算式)。________________________________________________________
【答案】[Ar]3d54s2或1s22s22p63s23p63d54s2 Mn的3d能级半满,较稳定,不易失去电子 NCl3和HCN均为分子晶体,NCl3的相对分子质量较大,则熔沸点更高 ![]()
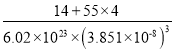
【解析】
(1)![]() 是25号元素,基态
是25号元素,基态![]() 原子的电子排布式为[Ar]3d54s2或1s22s22p63s23p63d54s2,锰的第三电离能是失去3d轨道中的电子,又
原子的电子排布式为[Ar]3d54s2或1s22s22p63s23p63d54s2,锰的第三电离能是失去3d轨道中的电子,又![]() 的3d轨道半满,稳定,不易失去电子,故电离能大于铁;
的3d轨道半满,稳定,不易失去电子,故电离能大于铁;
(2)NCl3和HCN均为分子晶体,NCl3的相对分子质量较大,分子间作用力更强,则NCl3的沸点更高;
(3)根据价层电子对互斥理论计算,NCl3的中心原子价层电子对数![]() ,
,![]() 的中心原子价层电子对数为
的中心原子价层电子对数为![]() ,
,![]() 的中心原子价层电子对数为
的中心原子价层电子对数为![]() ,故中心原子价层电子对数不同于其他微粒的是
,故中心原子价层电子对数不同于其他微粒的是![]() ;
;
(4)![]() (氮化锰)的晶胞结构可知,含1mol
(氮化锰)的晶胞结构可知,含1mol![]() ,晶胞参数为0.3851nm。该氮化锰的密度为:
,晶胞参数为0.3851nm。该氮化锰的密度为: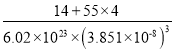
![]() 。
。

【题目】在标准状况下进行甲、乙、丙三组实验。三组实验各取同浓度的盐酸30mL,加入同一种镁铝合金粉末,产生气体。有关数据列表如下(气体体积均为标准状况下测得):
实验序号 | 甲 | 乙 | 丙 |
合金质量/mg | 255 | 385 | 459 |
气体体积/mL | 280 | 336 | 336 |
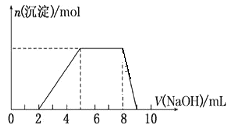
(1)乙组实验中,盐酸_____________(填“过量”、“适量”或“不足量”),理由是_________。
(2)要计算盐酸的物质的量浓度,题中可做计算依据的是____。
(3)合金中Mg、Al的物质的量之比为_________________。
(4)在丙组实验后,向容器中加入1mol/L的NaOH溶液,能使合金中的铝恰好溶解,不形成铝的沉淀,并使Mg2+刚好沉淀完全,求所加NaOH溶液的体积。(写出计算过程)_____________