题目内容
【题目】某溶液中可能含有如下离子:H+、Mg2+、Al3+、NH4+、Cl-、AlO2-。当向该溶液中逐滴加入NaOH溶液时,产生沉淀的物质的量(n)与加入 NaOH 溶液的体积(V)的关系如图所示,下列说法正确的是
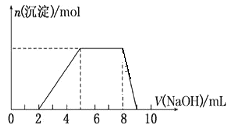
A.原溶液中一定含有的阳离子是H+、Mg2+、Al3+、NH4+
B.原溶液中 Al3+与NH4+的物质的量之比为 1∶3
C.反应最后形成的溶液中的溶质含AlCl3
D.原溶液中含有的阴离子是Cl-、AlO2-
【答案】B
【解析】
向溶液中滴加NaOH溶液时先没有沉淀生成,说明溶液中含有H+,溶液呈酸性,则溶液中不存在AlO2,当H+完全反应后继续滴加NaOH溶液,有沉淀生成,当沉淀最大时继续滴加NaOH溶液,沉淀的物质的量不变,说明NaOH和NH4+反应,则溶液中一定含有NH4+,当NH4+完全反应后继续滴加NaOH溶液,沉淀逐渐减小最终消失,说明溶液中含有Al3+,不含Mg2+,最终溶液中溶质为NaCl、NH3![]() H2O和NaAlO2,据此分析解答。
H2O和NaAlO2,据此分析解答。
向溶液中滴加NaOH溶液时先没有沉淀生成,说明溶液中含有H+,溶液呈酸性,则溶液中不存在AlO2,当H+完全反应后继续滴加NaOH溶液,有沉淀生成,当沉淀最大时继续滴加NaOH溶液,沉淀的物质的量不变,说明NaOH和NH4+反应,则溶液中一定含有NH4+,当NH4+完全反应后继续滴加NaOH溶液,沉淀逐渐减小最终消失,说明溶液中含有Al3+,不含Mg2+,最终溶液中溶质为NaCl、NH3![]() H2O和NaAlO2;
H2O和NaAlO2;
A.通过以上分析知,原溶液中一定含有的阳离子有H+、Al3+、NH4+,故A错误;
B.根据图象知,Al3+、NH4+消耗NaOH的物质的量之比为3:3,根据Al3++3OH=Al(OH)3↓、NH4++OH=NH3![]() H2O知,原溶液中Al3+与NH4+的物质的量之比1:3,故B正确;
H2O知,原溶液中Al3+与NH4+的物质的量之比1:3,故B正确;
C.通过以上分析知,最终得到的溶液中溶质为NaCl、NH3![]() H2O和NaAlO2,故C错误;
H2O和NaAlO2,故C错误;
D.通过以上分析知,原来溶液呈酸性,则一定不存在弱酸根离子AlO2,故D错误;
故答案选B。

【题目】如图所示,是元素周期表的一部分,请回答下列问题。
① | He | ||||||
Li | X | ② | ③ | Ne | |||
Na | Y | Z | Ar | ||||
(1)请画出图中元素Y的原子结构示意图___。
(2)如图为元素周期表的一部分:X、Y、Z代表三种不同元素,以下判断正确的是(______)
A.质子数:Y>Z
B.核外电子数:X=Y
C.Y和Z位于同一周期
(3)下列各组原子具有相似化学性质的是(______)
A.He、Mg
B.O、S
C.Cl、Ar
(4)2019年4月,《自然》杂志发文宣布科学家首次在太空中检测到氦合氢离子(HeH+),1个HeH+有__个电子。