题目内容
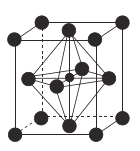
【题目】镍及其化合物用途广泛。某矿渣的主要成分是![]() (铁酸镍)、NiO、FeO、CaO、
(铁酸镍)、NiO、FeO、CaO、![]() 等,以下是从该矿渣中回收
等,以下是从该矿渣中回收![]() 的工艺路线:
的工艺路线:
已知:![]() 在350℃以上会分解生成
在350℃以上会分解生成![]() 和
和![]() 。
。![]() 在焙烧过程中生成
在焙烧过程中生成![]() 、
、![]() 。锡(Sn)位于第五周期第ⅣA族。
。锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与![]() 混合研磨,混合研磨的目的是________。
混合研磨,混合研磨的目的是________。
(2)“浸泡”过程中![]() 生成
生成![]() 的离子方程式为________,“浸渣”的成分除
的离子方程式为________,“浸渣”的成分除![]() 、
、![]() 外还含有________(填化学式)。
外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入![]() 将
将![]() 还原为
还原为![]() ,所需
,所需![]() 的物质的量不少于
的物质的量不少于![]() 物质的量的________倍;除去过量的
物质的量的________倍;除去过量的![]() 后,再用酸性
后,再用酸性![]() 标准溶液滴定溶液中的
标准溶液滴定溶液中的![]() ,还原产物为
,还原产物为![]() ,滴定时反应的离子方程式为________。
,滴定时反应的离子方程式为________。
(4)“浸出液”中![]() ,当除钙率达到99%时,溶液中
,当除钙率达到99%时,溶液中![]() ________
________![]() [已知
[已知![]() ]
]
(5)本工艺中,萃取剂与溶液的体积比(![]() 对溶液中
对溶液中![]() 、
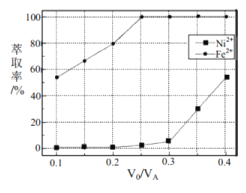
、![]() 的萃取率影响如图所示,
的萃取率影响如图所示,![]() 的最佳取值是________。
的最佳取值是________。
【答案】增大接触面积,加快反应速率,使反应更充分 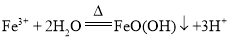
![]() 、
、![]() 0.5
0.5 
![]() 0.25
0.25
【解析】
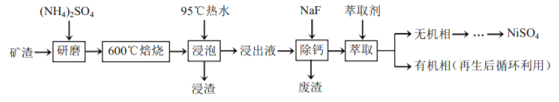
某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵研磨后,600°C焙烧,已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成NiSO4、Fe2(SO4)3,在90°C的热水中浸泡过滤得到浸出液,加入NaF除去钙离子,过滤得到滤液加入萃取剂得到无机相和有机相,无机相通过一系列操作得到硫酸镍,有机相循环使用。
(1)混合研磨增大接触面积,加快反应速率;
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的反应为水解反应,矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,加入硫酸铵在600°C焙烧,然后热水浸泡,浸取后的浸渣为FeO(OH)、焙烧是生成的Fe2O3以及微溶于水的硫酸钙和不溶于水的二氧化硅;
(3)用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,依据氧化还原反应定量关系计算得到SnCl2的物质的量不少于Fe3+物质的量的倍数,用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,亚铁离子被氧化为铁离子;
(4)浸出液”中c(Ca2+)=1.0×10-3molL-1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3mol/L=1.0×10-5mol/L,结合溶度积常数计算得到溶液中c(F-);
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图2所示,最佳取值是镍离子不能被萃取,亚铁离子被萃取,据此选择。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是增大接触面积,加快反应速率,使反应更充分,故答案为增大接触面积,加快反应速率,使反应更充分;
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为: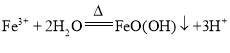 ,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4,故答案为
,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4,故答案为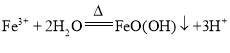 ; SiO2、CaSO4;
; SiO2、CaSO4;
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为:2Fe3++Sn2+=Sn4++2Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的一半,为0.5倍,用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为:Cr2O27+6Fe2++14H+=2Cr3++6Fe3++7H2O,故答案为0.5; Cr2O27+6Fe2++14H+=2Cr3++6Fe3++7H2O;
(4)浸出液”中c(Ca2+)=1.0×103molL1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3mol/L=1.0×10-5mol/L,溶液中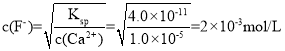 ,故答案为2.0×103;
,故答案为2.0×103;
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图2所示,最佳取值是镍离子不能被萃取,亚铁离子被萃取,V0/VA的最佳取值是0.25,故答案为0.25。

 阅读快车系列答案
阅读快车系列答案【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
A. 实验时的温度T2高于T1
B. 2号Cu2O的催化效率比1号Cu2O的催化效率高
C. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1
D. 等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关