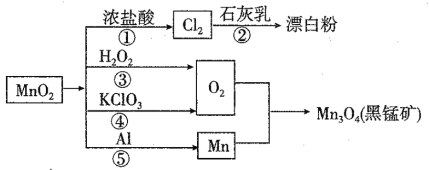
题目内容
【题目】将某有机物样品3.0g通入足量的氧气后充分燃烧,在120℃条件下将燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g,然后将气体再通入足量的氢氧化钡溶液中,可得到沉淀19.7g(不考虑溶解的沉淀物),此时还有标准状况下的气体2.24L,该气体能用于抢救危重病人。实验测得该有机物蒸气的密度是相同条件下氦气的15倍。求该有机物的分子式和通入氧气的总体积(标准状况)?____________
【答案】4.48L
【解析】
实验测得同体积的该有机物蒸气与氦气的质量之比为15,可知该有机物的相对分子质量为15×4=60;3.0g有机物燃烧,燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g为水的质量;然后将气体再通入足量的氢氧化钡溶液中,可得到沉淀19.7g为BaCO3;结合碳元素和氢元素的质量之和判断是否存在氧元素,最后根据有机物的结构简式判断耗氧量;最后还剩余标准状况下的气体2.24L,该剩余气体可用于抢救危重病人,故剩余的气体为氧气,据此分析计算。
实验测得同体积的该有机物蒸气与氦气的质量之比为15,可知该有机物的相对分子质量为15×4=60;
3.0g有机物燃烧,燃烧后的气体通入足量的浓H2SO4中,浓H2SO4增重1.8g为水的质量,则水的物质的量n=![]() =0.1mol,0.1mol水中含有的0.2mol氢原子全部来自于此有机物,即3.0g有机物中含有的氢原子的物质的量为0.2mol,质量m=nM=0.2mol×1g/mol=0.2g;
=0.1mol,0.1mol水中含有的0.2mol氢原子全部来自于此有机物,即3.0g有机物中含有的氢原子的物质的量为0.2mol,质量m=nM=0.2mol×1g/mol=0.2g;
然后将气体再通入足量的氢氧化钡溶液中,可知得到沉淀19.7g为BaCO3,n(BaCO3)=![]() =0.1mol,生成0.1molBaCO3沉淀需要的0.1molCO2中含0.1molC原子全部来自于此有机物,则3.0g有机物中的碳原子的物质的量为0.1mol,质量m=nM=0.1mol×12g/mol=1.2g;
=0.1mol,生成0.1molBaCO3沉淀需要的0.1molCO2中含0.1molC原子全部来自于此有机物,则3.0g有机物中的碳原子的物质的量为0.1mol,质量m=nM=0.1mol×12g/mol=1.2g;
由于(0.2g+1.2g)<3.0g,故有机物中还含氧原子,且含有的氧原子的质量m=3.0g-0.2g-1.2g=1.6g,氧原子的物质的量n=![]() =0.1mol;
=0.1mol;
故此有机物中C、H、O原子个数之比为为0.1∶0.2∶0.1=1∶2∶1,即此有机物的最简式为CH2O,设有机物的分子式为(CH2O)n,根据其相对分子质量为60,可知有:30n=60,即可解得n=2,即有机物分子式为C2H4O2;
3.0gC2H4O2的物质的量n=![]() =0.05mol,设燃烧时的耗氧量为Xmol,根据C2H4O2~2O2可知X=0.1mol,则消耗掉的氧气在标况下的体积V=nVm=0.1mol×22.4L/mol=2.24L,由于最后还剩余标准状况下的气体2.24L,该剩余气体可用于抢救危重病人,故剩余的气体也为氧气,故通入的氧气的总体积V总=2.24L+2.24L=4.48L,故答案为:4.48L。
=0.05mol,设燃烧时的耗氧量为Xmol,根据C2H4O2~2O2可知X=0.1mol,则消耗掉的氧气在标况下的体积V=nVm=0.1mol×22.4L/mol=2.24L,由于最后还剩余标准状况下的气体2.24L,该剩余气体可用于抢救危重病人,故剩余的气体也为氧气,故通入的氧气的总体积V总=2.24L+2.24L=4.48L,故答案为:4.48L。

【题目】工业制纯碱,是向饱和食盐水中通入氨气和二氧化碳,获得碳酸氢钠晶体,它的反应原理可用下列化学方程式表示:
NH3+CO2+H2O=NH4HCO3①
NH4HCO3+NaCl(饱和)=NaHCO3↓+NH4Cl②
将所得碳酸氢钠晶体加热分解后即可得到纯碱。请回答:
(1)工业所制纯碱中常含有少量的氯化钠杂质,其原因___________________________;
(2)现有甲、乙、丙三个小组的学生,欲测定某工业纯碱样品中Na2CO3的质量分数,分别设计并完成实验如下。
甲组:取10.00g样品,利用下图所示装置,测出反应后装置C中碱石灰的增重为3.52g。
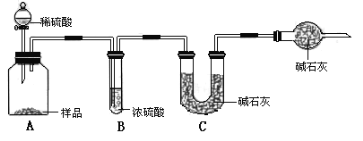
乙组:取10.00g样品,配成1000mL溶液,用碱式滴定管量取25.00mL放入锥形瓶中,加入甲基橙作指示剂,用0.150mol·L-1的标准盐酸溶液滴定至终点(有关反应为Na2CO3+2HCl=2CaCl2+H2O+CO2↑)。完成三次实验后,消耗盐酸体积的平均值为30.00mL。
丙组:取10.00g样品,向其中加入过量的盐酸,直至样品中无气泡冒出,加热蒸发所得物并在干燥器中冷却至室温后称量。反复加热、冷却、称量,直至所称量的固体质量几乎不变为止,此时所得固体的质量为10.99g。
请分析、计算后填表:
分析与 计算 分组 | 计算样品中碳酸钠 的质量分数 | 对实验结果 的评价 | 实验失败的主要原因 及对结果的影响 |
甲组 | _______________ | 失败 | ____________ |
乙组 | ____________ | 成功 | |
丙组 | ______________ | 成功 |