题目内容
【题目】醋柳酯是一种镇咳祛痰药,用于上呼吸道感染、感冒咳嗽、急慢性支气管炎等的治疗,回答下列问题:
(1)醋柳酯的分子式为_____________________。
(2)关于醋柳酯的说法中,正确的是_________
A.核磁共振氢谱中只有6个吸收峰 B.能发生取代、加成、氧化反应
C.1mol该物质最多可以和7molH2反应 D.分子中所有原子一定在同一平面内
(3)醋柳酯可由下图所示路线合成:
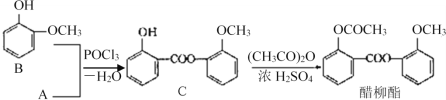
①A的结构简式为__________;中间产品C中混有反应物A和B,检验C中含有A的试剂是______________________。
②由C制醋柳酯的反应类型为____________________;写出C和足量NaOH溶液反应的化学方程式________。
③A的同分异构体很多,其中属于酯类、且能与FeCl3溶液反应显紫色的同分异构体有__种,写出一种的结构简式_______。
【答案】C16H14O5 B 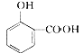 NaHCO3溶液 取代反应
NaHCO3溶液 取代反应  +3NaOH→
+3NaOH→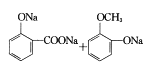 +2H2O 3种
+2H2O 3种 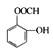
![]()
![]()
【解析】
⑴根据醋柳酯的结构简式写出其分子式为C16H14O5。
⑵A选项,醋柳酯没有对称轴,因此核磁共振氢谱中有10个吸收峰;B选项,醋柳酯含有酯基能发生水解,含有苯环能发生加成,能燃烧发生氧化反应;C选项,1mol醋柳酯含有2mol苯环,最多可以和6molH2反应;D选项,分子中含有甲基,因此分子中所有原子一定不在同一平面内;
⑶①根据A+B生成C的反应和前后联系得出A的结构简式为 ;中间产品C中混有反应物A和B,A中含有羧基而C中不含有羧基,因此检验C中含有A的试剂是NaHCO3溶液。
;中间产品C中混有反应物A和B,A中含有羧基而C中不含有羧基,因此检验C中含有A的试剂是NaHCO3溶液。
②根据C和醋柳酯得出由C制醋柳酯的反应类型为取代反应;C中含有酚羟基和酸酚酯,因此可得C和足量NaOH溶液反应的化学方程式。
③A的同分异构体很多,其中属于酯类、且能与FeCl3溶液反应显紫色说明含有酯基和酚羟基,因此同分异构体为 、
、![]() 、
、![]() 。
。
⑴根据醋柳酯的结构简式写出其分子式为C16H14O5,故答案为:C16H14O5。
⑵A选项,醋柳酯没有对称轴,因此核磁共振氢谱中有10个吸收峰,故A错误;
B选项,醋柳酯含有酯基能发生水解,含有苯环能发生加成,能燃烧发生氧化反应,故B正确;
C选项,1mol醋柳酯含有2mol苯环,因此该物质最多可以和6molH2反应,故C错误;
D选项,分子中含有甲基,因此分子中所有原子一定不在同一平面内,故D错误;
综上所述,答案为B。
⑶①根据A+B生成C的反应和前后联系得出A的结构简式为 ;中间产品C中混有反应物A和B,A中含有羧基而C中不含有羧基,因此检验C中含有A的试剂是NaHCO3溶液;
;中间产品C中混有反应物A和B,A中含有羧基而C中不含有羧基,因此检验C中含有A的试剂是NaHCO3溶液;
故答案为:NaHCO3溶液;
②根据C和醋柳酯得出由C制醋柳酯的反应类型为取代反应;C中含有酚羟基和酸酚酯,因此C和足量NaOH溶液反应的化学方程式 +3NaOH→
+3NaOH→ + 2H2O;
+ 2H2O;
故答案为: +3NaOH→
+3NaOH→ +2H2O;
+2H2O;
③A的同分异构体很多,其中属于酯类、且能与FeCl3溶液反应显紫色说明含有酯基和酚羟基,因此同分异构体为 、
、![]() 、
、![]() ;
;
故答案为:3种; 或
或![]() 或
或![]() 。
。

【题目】如图所示,是元素周期表的一部分,请回答下列问题。
① | He | ||||||
Li | X | ② | ③ | Ne | |||
Na | Y | Z | Ar | ||||
(1)请画出图中元素Y的原子结构示意图___。
(2)如图为元素周期表的一部分:X、Y、Z代表三种不同元素,以下判断正确的是(______)
A.质子数:Y>Z
B.核外电子数:X=Y
C.Y和Z位于同一周期
(3)下列各组原子具有相似化学性质的是(______)
A.He、Mg
B.O、S
C.Cl、Ar
(4)2019年4月,《自然》杂志发文宣布科学家首次在太空中检测到氦合氢离子(HeH+),1个HeH+有__个电子。
【题目】为探究H2O2、SO2、Br2氧化性强弱,某小组同学设计如下实验(夹持及尾气处理装置已略去,气密性已检验)。

实验操作 | 实验现象 |
i.打开A中分液漏斗活塞,滴加浓硫酸 | A中有气泡产生,B中红棕色溴水褪色,C中有白色沉淀 |
ii.取C中沉淀加入盐酸 | C中白色沉淀不溶解 |
iii.打开B中分液漏斗活塞,逐滴滴加H2O2 | 开始时颜色无明显变化;继续滴加H2O2溶液,一段时间后,混合液逐渐变成红棕色 |
(1)C中产生的白色沉淀是______。
(2)甲同学通过C中产生白色沉淀,得出结论,氧化性:H2O2>SO2。
①乙同学认为不能得出此结论,对实验进行了改进:
打开弹簧夹,通入N2,待排净装置内空气后,关闭弹簧夹,再打开A中分液漏斗活塞,此操作的目的是_________________
②丙同学进行了进一步的改进:
在B和C之间增加盛放CCl4的洗气瓶D,丙同学的目的是______
③将乙和丙同学改进后的方案进行实验,C中产生白色沉淀,得出结论:
氧化性H2O2>SO2。试写出两者反应的化学方程式________________
(3)iii中滴入少量H2O2没有明显变化。提出假设:
观点1:H2O2的量少不能氧化Br-
观点2:B中有未反应H2SO3(或SO2)
为验证观点2,应进行的实验操作及现象是______。
(4)通过上述全部实验,得出结论:H2O2、SO2、Br2氧化性由强到弱的顺序是______。
【题目】在相同的密闭容器中,用高纯度纳米级Cu2O分别进行催化分解水的实验:2 H2O(g)![]() 2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
2 H2(g) + O2(g) H>0,实验测得反应体系中水蒸气浓度(mol·L-1)的变化结果如下:
序号 | 时间/min | 0 | 10 | 20 | 30 | 40 | 60 |
① | 温度T1 / 1号Cu2O | 0.0500 | 0.0492 | 0.0486 | 0.0482 | 0.0480 | 0.0480 |
② | 温度T1 / 2号Cu2O | 0.0500 | 0.0490 | 0.0483 | 0.0480 | 0.0480 | 0.0480 |
③ | 温度T2 / 2号Cu2O | 0.0500 | 0.0480 | 0.0470 | 0.0470 | 0.0470 | 0.0470 |
下列说法不正确的是( )
A. 实验时的温度T2高于T1
B. 2号Cu2O的催化效率比1号Cu2O的催化效率高
C. 实验①前20 min的平均反应速率v(O2) = 7×10ˉ5 mol·Lˉ1·minˉ1
D. 等质量纳米级Cu2O比微米级Cu2O催化效率高,这与Cu2O的粒径大小有关