题目内容
18.(1)胃液中含有盐酸,胃酸过多的人常有胃疼烧心的感觉,易吐酸水,服用适量的小苏打(NaHCO3),能治疗胃酸过多,请写出其反应的离子方程式:HCO3-+H+=CO2↑+H2O.如果病人同时患胃溃疡,为防胃壁穿孔,此时最好用含氢氧化铝的胃药(如胃舒平)离子方程式:Al(OH)3+3H+=Al3++3H2O.(2)在 CH4+2O2═CO2+2H2O反应中,请用单线桥法标出电子转移情况:
 .
.
分析 (1)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳;
氢氧化铝与盐酸反应生成氯化铝和水;
(2)反应中碳元素由-4价升高到二氧化碳中+4价,失去8个电子,氧原子得到8个电子生成-2价氧.
解答 解:(1)碳酸氢钠与盐酸反应生成氯化钠、水和二氧化碳,离子方程式:HCO3-+H+=CO2↑+H2O;
故答案为:HCO3-+H+=CO2↑+H2O;
氢氧化铝与盐酸反应生成氯化铝和水,离子方程式:Al(OH)3+3H+=Al3++3H2O;
故答案为:Al(OH)3+3H+=Al3++3H2O;
(2)反应中碳元素由-4价升高到二氧化碳中+4价,失去8个电子,氧原子得到8个电子生成-2价氧,用双线桥表示为: ;
;
故答案为: .
.
点评 本题考查了离子方程式书写、氧化还原反应单线桥表示方法,明确反应实质、氧化还原反应中元素化合价变化及单先桥表示注意事项是解题关键,题目难度不大.

练习册系列答案
 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案
相关题目
8. 向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m 与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法不正确的是( )
向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m 与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法不正确的是( )
 向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m 与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法不正确的是( )
向含有一定量盐酸和少量MgSO4的混合溶液中逐滴加入Ba(OH)2溶液,产生沉淀的质量m 与加入Ba(OH)2的物质的量n之间的关系如图所示,下列说法不正确的是( )| A. | O→a时的反应的离子方程式为:Ba2++2OH-+SO42-+Mg2+═BaSO4↓+Mg(OH)2↓ | |
| B. | a→b时发生的离子反应为H++OH-=H2O | |
| C. | 从a→b→c说明溶液中结合OH-的能力强弱为:H+>Mg2+ | |
| D. | 原混合溶液中 C(HCl):C(MgSO4)=4:1 |
6.已知下述三个实验均能发生化学反应.①将铁钉放入硫酸铜溶液中;②向硫酸亚铁溶液中滴入几滴浓硝酸;③将铁钉放入氯化铁溶液中.下列判断正确的是( )
| A. | 实验①和③中的铁钉只作还原剂 | |
| B. | 上述实验证明氧化性:Fe3+>Fe2+>Cu2+ | |
| C. | 实验②中Fe2+既显氧化性又显还原性 | |
| D. | 实验③中反应的离子方程式为2Fe+Fe3+═3Fe2+ |
3.X、Y、Z、W是元素周期表前四周期中的四种常见元素,其相关信息如下表:
(1)Y离子半径>Z离子半径(选填“>”、“=”、“<”).
(2)XY2是一种常用的溶剂,一个XY2的分子中存在2个σ键,2个π键.
(3)在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是F-S.
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到溶液由天蓝色最终变为深蓝色.反应过程中涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
| 元素 | 相 关 信 息 |
| X | X的基态原子核外3个能级上有电子,且每个能级上的电子数相等 |
| Y | Y元素的激发态原子的电子排布式为1s22s22p63s23p34s1 |
| Z | Z和Y同周期,Z的电负性大于Y |
| W | W的一种核素的质量数为63,中子数为34 |
(2)XY2是一种常用的溶剂,一个XY2的分子中存在2个σ键,2个π键.
(3)在H-Y、H-Z两种共价键中,键的极性较强的是H-Cl,键长较长的是F-S.
(4)向WYO4的水溶液中逐滴加入氨水至过量,观察到溶液由天蓝色最终变为深蓝色.反应过程中涉及的离子方程式为:Cu2++2NH3•H2O=Cu(OH)2+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-.
7.如图是某化学反应的示意图(“○”与“o”分别代表不同元素原子),该反应可能为( )


| A. | 氢气的燃烧 | B. | 水的电解 | C. | 甲烷的燃烧 | D. | 一氧化碳的燃烧 |
7.阿司匹林是一种历史悠久的解热镇痛药,学名为乙酰水杨酸,结构简式为 .某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
.某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:

已知:①乙酰水杨酸是白色晶体,易溶于乙醇、乙醚,在128~135℃易分解.
②主要试剂和产品的其它物理常数
请根据以上信息回答下列问题:
(1)写出水杨酸与醋酸酐制备阿司匹林的化学方程式 .
.
(2)制备阿司匹林主反应时,仪器必须干燥的原因是防止醋酸酐与水反应.
(3)合成阿司匹林主反应时,最合适的加热方法是水浴加热,除酒精灯外,该加热装置还需要的玻璃仪器有烧杯(或水浴锅)、温度计.
(4)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤(即减压过滤),结合提纯流程回答加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液反应,转化为易溶于水的乙酰水杨酸钠,便于分离.
(5)最终所得产品可能仍含有少量水杨酸,检验含有水杨酸的操作和现象是取少量粗产品于试管中,加适量乙醇(或蒸馏水)溶解,滴加几滴FeCl3溶液,若呈紫色则含水杨酸,若无紫色出现,说明产品中不含水杨酸..
 .某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
.某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
已知:①乙酰水杨酸是白色晶体,易溶于乙醇、乙醚,在128~135℃易分解.
②主要试剂和产品的其它物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 132 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 与水反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)写出水杨酸与醋酸酐制备阿司匹林的化学方程式
 .
.(2)制备阿司匹林主反应时,仪器必须干燥的原因是防止醋酸酐与水反应.
(3)合成阿司匹林主反应时,最合适的加热方法是水浴加热,除酒精灯外,该加热装置还需要的玻璃仪器有烧杯(或水浴锅)、温度计.
(4)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤(即减压过滤),结合提纯流程回答加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液反应,转化为易溶于水的乙酰水杨酸钠,便于分离.
(5)最终所得产品可能仍含有少量水杨酸,检验含有水杨酸的操作和现象是取少量粗产品于试管中,加适量乙醇(或蒸馏水)溶解,滴加几滴FeCl3溶液,若呈紫色则含水杨酸,若无紫色出现,说明产品中不含水杨酸..
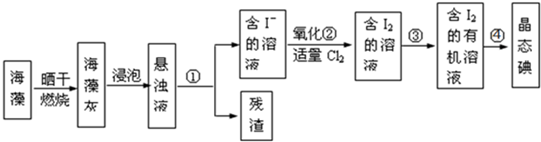
 (1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.
(1)从含碘的有机溶液中提取碘和回收有机溶剂,需要经过蒸馏,指出下面蒸馏装置图中的错误之处.