题目内容
7.阿司匹林是一种历史悠久的解热镇痛药,学名为乙酰水杨酸,结构简式为 .某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
.某探究小组在实验室探究阿司匹林的合成,主要原料是水杨酸(邻羟基苯甲酸)与醋酸酐[(CH3CO)2O],制备基本实验流程如下:
已知:①乙酰水杨酸是白色晶体,易溶于乙醇、乙醚,在128~135℃易分解.
②主要试剂和产品的其它物理常数
| 名称 | 相对分子质量 | 熔点或沸点(℃) | 水溶性 |
| 水杨酸 | 132 | 158(熔点) | 微溶 |
| 醋酸酐 | 102 | 139.4(沸点) | 与水反应 |
| 乙酰水杨酸 | 180 | 135(熔点) | 微溶 |
(1)写出水杨酸与醋酸酐制备阿司匹林的化学方程式
 .
.(2)制备阿司匹林主反应时,仪器必须干燥的原因是防止醋酸酐与水反应.
(3)合成阿司匹林主反应时,最合适的加热方法是水浴加热,除酒精灯外,该加热装置还需要的玻璃仪器有烧杯(或水浴锅)、温度计.
(4)提纯粗产品时加入饱和NaHCO3溶液至没有CO2产生为止,再抽滤(即减压过滤),结合提纯流程回答加饱和NaHCO3溶液的目的是使乙酰水杨酸与NaHCO3溶液反应,转化为易溶于水的乙酰水杨酸钠,便于分离.
(5)最终所得产品可能仍含有少量水杨酸,检验含有水杨酸的操作和现象是取少量粗产品于试管中,加适量乙醇(或蒸馏水)溶解,滴加几滴FeCl3溶液,若呈紫色则含水杨酸,若无紫色出现,说明产品中不含水杨酸..
分析 水杨酸和醋酸酐加入浓硫酸反应,摇匀水浴加热85°C-90°C,冷却得到阿司匹林,抽滤洗涤得到粗产品,加入饱和碳酸氢钠溶液至没有CO2产生为止,使乙酰水杨酸与NaHCO3溶液反应,转化为易溶于水的乙酰水杨酸钠,便于分离,加入盐酸生成水杨酸,再抽滤(即减压过滤)干燥,得到较纯净的阿司匹林,
(1)由水杨酸、乙酸酐与阿司匹林的结构可知,水杨酸中酚羟基中H原子与乙酸酐中-OCCH3交换,同时生成CH3COOH;
(2)乙酸酐容易发生水解,故仪器应干燥;
(3)控制温度在85℃~90℃,温度对于100℃,应采取水浴加热,依据该加热装置选择仪器,水浴加热是利用加热水,用温度计控制水的温度,达到反应所需温度;
(4)乙酰水杨酸为微溶于水的物质,加入盐之后可以转化为易溶于水的盐,易与不溶性杂质分离;
(5)水杨酸含有酚羟基,加适量乙醇(或蒸馏水)溶解,遇氯化铁溶液呈紫色,据此设计检验检验产品中是否混有水杨酸;
解答 解:(1)由水杨酸、乙酸酐与阿司匹林的结构可知,水杨酸中酚羟基中H原子与乙酸酐中-OCCH3交换,同时生成CH3COOH,反应方程式为: ,
,
故答案为: ;
;
(2)乙酸酐容易发生水解生成乙酸,故仪器应干燥防止乙酸酐水解,故答案为:防止乙酸酐水解;
(3)控制温度在85℃~90℃,小于100℃,应使用水浴加热,水浴加热是利用加热水,用温度计控制水的温度,达到反应所需温度,除酒精灯外,该加热装置还需要的玻璃仪器有,烧杯(或水浴锅),温度计,
故答案为:水浴加热;烧杯(或水浴锅),温度计;
(4)乙酰水杨酸为微溶于水的物质,加入盐之后可以转化为易溶于水的盐,易与不溶性杂质分离,
故答案为:使乙酰水杨酸与NaHCO3溶液作用转化为易溶于水的乙酰水杨酸钠,与不溶性杂质分离;
(5)水杨酸含有酚羟基,遇氯化铁溶液呈紫色,具体方案为:向水中加入少量产品,加适量乙醇(或蒸馏水)溶解,然后滴加FeCl3溶液,若有紫色出现,说明产品中有水杨酸;若无紫色出现,说明产品中不含水杨酸,
故答案为:向水中加入少量产品,加适量乙醇(或蒸馏水)溶解,然后滴加FeCl3溶液,若有紫色出现,说明产品中有水杨酸;若无紫色出现,说明产品中不含水杨酸.
点评 本题考查有机物的合成、实验基本操作、物质的分离提纯、实验方案设计等,题目难度中等,注意掌握基本操作与有机物的性质.

 计算高手系列答案
计算高手系列答案 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )a.氧化 b.还原 c.取代 d.加成e.消去 f.中和 g.缩聚 h.酯化.
| A. | b、d、f、g、h | B. | e、d、c、a、h | C. | a、e、d、c、h | D. | b、a、e、c、f |
| A. | Cu$\stackrel{{H}_{2}S{O}_{4}}{→}$CuSO4$\stackrel{Ba(N{O}_{3})_{2}}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| C. | Cu$\stackrel{{O}_{2}}{→}$CuO$\stackrel{{H}_{2}O}{→}$Cu(OH)2$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 | |
| D. | Cu$\stackrel{HN{O}_{3}}{→}$Cu(NO3)2 |
艺流程如下:
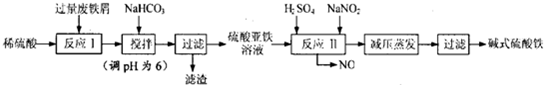
请回答下列问题:
(1)碱式硫酸铁能够净水的原因是能水解生成吸附能力很强的胶体.
(2)已知,常温下部分阳离子以氢氧化物形式完全沉淀时溶液的pH如下表.假设沉淀完全时溶液中金属离子的浓度为1×10-5 mol•L-1,估算Ksp[Fe(OH)2]=1×10-15.生产碱式硫酸铁的过程中,加入少量NaHCO3
调溶液pH=6的目的是调节溶液的pH促进Al3+水解转化为沉淀完全除去.
| 沉淀物 | Fe(OH)2 | Fe(OH)3 | Al (OH)3 |
| 开始沉淀时的pH | 7.0 | 1.9 | 3.4 |
| 完全沉淀时的pH | 9.0 | 3.2 | 4.7 |
(4)在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁.根据我国质量标准,产品中不得含有Fe2+及NO${\;}_{3}^{-}$.某同学根据提供的试剂设计实验检验所得产品中不含Fe2+,含有 SO${\;}_{4}^{2-}$,可供选择的试剂如下:
A.新制氯水 B.0.l mol/L KSCN溶液 C.10%NaOH溶液
D.20%HNO3溶液 E.0.05mol/L酸性KMnO4溶液 F.0.l mol/L BaCl2溶液
请你帮助该同学完成实验,将相关项目填入下表:
| 实验操作 | 现象 | 结论 |
| 取适量产品于洁净烧杯中,加入适量蒸馏水,充分搅拌,静置,滤去沉淀. | 得黄棕色溶液 | |
| 取少量溶液于试管中,滴加溶液 ①0.05mol/L酸性高锰酸钾; | ②溶液不褪色; | 溶液中不含Fe2+ |
| 取少量溶液于试管中,滴加0.1 mol/L BaCl2溶液,再滴加20% HNO3溶液 | ③产生白色沉淀; | 溶液中含有SO${\;}_{4}^{2-}$ |
 .
.
 ;Z2X4结构式
;Z2X4结构式 .
.