题目内容
9.(1)甲烷在空气中完全燃烧的化学方程式为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O;(2)燃烧11.2L(标准状况)甲烷,消耗氧气的物质的量是1mol,生成二氧化碳的物质的量是0.5mol,水的物质的量是1mol.
分析 (1)甲烷燃烧生成二氧化碳和水,结合原子守恒配平书写化学方程式;
(2)燃烧11.2L(标准状况)甲烷,物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,结合化学方程式定量关系计算得到二氧化碳和水的物质的量;
解答 解:(1)甲烷在空气中完全燃烧的化学方程式为CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,
故答案为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O;
(2)燃烧11.2L(标准状况)甲烷,物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol
CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,
1 2 1 2
0.5mol 1mol 0.5mol 1mol
得到O2:1mol,CO2:0.5mol,H2O:1mol,
故答案为:1mol,0.5mol,1mol;
点评 本题考查了有机物燃烧化学方程式书写,化学方程式的计算分析应用,掌握基础是解题关键,题目较简单.

练习册系列答案
 优学名师名题系列答案
优学名师名题系列答案
相关题目
19.要除去Na2S04溶液中含有的MgS04,应选用的试剂和操作方法是( )
| A. | 加入适量BaCl2溶液后过滤 | B. | 加入适量NaOH溶液后过滤 | ||
| C. | 加入过量NaOH溶液后过滤 | D. | 加入过量Ba(OH)2溶液后过滤 |
17.在下述条件下,一定能大量共存的离子组是( )
| A. | 透明的水溶液中:K+、Mg2+、SO42-、MnO4- | |
| B. | 含有大量NO3-的水溶液中:NH4+、Fe2+、SO42-、H+ | |
| C. | 在pH=7的溶液中:Na+、Fe3+、SO42-、Br- | |
| D. | 强碱性溶液中:ClO-、S2-、HSO3-、Na+ |
4.下列示意图与对应的反应情况正确的是( )
| A. |  含0.01 mol NaOH和0.01 mol Ba(OH)2的混合溶液中缓慢通入CO2 | |
| B. |  KHCO3溶液中逐滴加入Ba(OH)2溶液 | |
| C. | 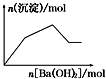 KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液 | |
| D. | 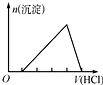 向含有少量氢氧化钠的偏铝酸钠溶液中滴加盐酸 |
1.已知还原性CI-<Br-<Fe2+<I-,氧化性CI2>Br2>Fe3+>12,则下列说法正确的是( )
| A. | 在含有Br、Fe2+、I-的溶液中欲只氧化I-而不氧化Br、Fe2+,可用FeBr3作试剂 | |
| B. | 向Fel2溶液中通入少量Cl2,反应的离子方程式为:2Fe2++Cl2═2Fe3++2C1- | |
| C. | 向FeBr2溶液中通入足量Cl2,反应的离子方程式为:2Fe2++2Br-+2Cl2═2Fe3++Br2+4CI- | |
| D. | 向FeCl2溶液中滴加足量碘水,能发生反应:2Fe2++12═2Fe3++2I- |
19.由1-丙醇制取 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )
a.氧化 b.还原 c.取代 d.加成e.消去 f.中和 g.缩聚 h.酯化.
 ,最简便的流程需要下列反应的顺序应是( )
,最简便的流程需要下列反应的顺序应是( )a.氧化 b.还原 c.取代 d.加成e.消去 f.中和 g.缩聚 h.酯化.
| A. | b、d、f、g、h | B. | e、d、c、a、h | C. | a、e、d、c、h | D. | b、a、e、c、f |
 .
. .
.