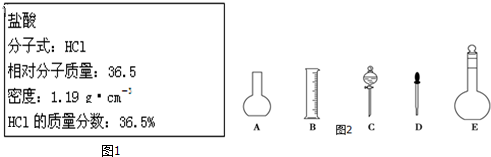
题目内容
11.欲配制500ml0.02mol•L-1的碳酸钠溶液,回答下列问题:(1)通过计算可知,应用托盘天平称取1.1 g碳酸钠.
(2)若砝码和药品位置颠倒(假设称量时未用烧杯,1g以下用游码),天平实际称得碳酸钠的质量是0.9g.
(3)在配制碳酸钠溶液的过程中应该用到的玻璃仪器有500mL容量瓶、玻璃棒、烧杯、胶头滴管
(4)如果称取的碳酸钠中含有少量水分,最后配制的碳酸钠溶液的浓度将偏低(填“偏高”、“偏低”或“无影响”,下同);定容时,如果仰视刻度线,则最后溶液的浓度将偏低.
分析 (1)根据n=cV计算出溶质碳酸钠的物质的量,再根据m=nM计算出需要碳酸钠的质量;
(2)根据托盘天平称量原理:物品质量=砝码+游码,计算出天平平衡时实际称得碳酸钠的质量;
(3)根据配制一定物质的量浓度的溶液的步骤选用需要的玻璃仪器;
(4)根据c=$\frac{n}{V}$可得,一定物质的量浓度溶液配制的误差都是由溶质的物质的量n和溶液的体积V引起的,误差分析时,关键要看配制过程中引起n和V怎样的变化:若n比理论值小,或V比理论值大时,都会使所配溶液浓度偏小;若n比理论值大,或V比理论值小时,都会使所配溶液浓度偏大.
解答 解:(1)配制500mL 0.02mol•L-1的碳酸钠溶液,需要碳酸钠的物质的量为:0.02mol•L-1×0.5L=0.01mol,需要碳酸钠的质量为:106g/mol×0.01molmol=1.1g,
故答案为:1.1;
(2)游码的质量为0.1g,天平称量原理为:物品质量=砝码+游码,若砝码和药品位置放颠倒,砝码读数=物品质量+游码,即天平平衡时实际称得碳酸钠的质量是:1.0g-0.1g=0.9g,
故答案为:0.9;
(3)配制500mL 0.02mol•L-1的碳酸钠溶液的步骤为:计算、称量、溶解、冷却、转移、洗涤、定容、摇匀等,需要的玻璃仪器仪器有:500mL容量瓶、玻璃棒、烧杯、胶头滴管,
故答案为:500mL容量瓶、玻璃棒、烧杯、胶头滴管;
(4)如果称取的碳酸钠中含有少量水分,导致称量的碳酸钠的物质的量的偏小,根据c=$\frac{n}{V}$可得,最后配制的碳酸钠溶液的浓度将偏低;
定容时,如果仰视刻度线,导致加入的蒸馏水体积偏大,根据c=$\frac{n}{V}$可得,最后配制的碳酸钠溶液的浓度将偏低,
故答案为:偏低;偏低.
点评 本题考查了配制一定物质的量浓度的溶液的方法,该题是中等难度的试题,试题基础性强,贴近高考,该题难易适中,注重灵活性,侧重对学生能力的培养和解题方法的指导和训练,有利于培养学生的逻辑思维能力和严谨的规范实验操作能力;该题的难点在于误差分析,注意明确误差分析的方法和技巧.

 孟建平错题本系列答案
孟建平错题本系列答案 超能学典应用题题卡系列答案
超能学典应用题题卡系列答案| A. | 二氧化硅的结构式:O=Si=O | |
| B. | H2O沸点高于NH3,是因为H2O分子间存在氢键而NH3分子间不存在氢键 | |
| C. | 含有金属离子的晶体一定是离子晶体 | |
| D. | 分子晶体中一定存在分子间作用力,不一定存在共价键 |
| A. | 羟基的电子式是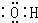 | |
| B. | 硝基苯的结构简式 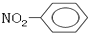 | |
| C. | CH3CH(CH3)CH=CH2的名称 3-甲基-1-丁烯 | |
| D. | 甲烷分子的比例模型 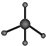 |
| A. | 溶液中NaOH的物质的量 | B. | 溶液中Na+的物质的量浓度 | ||
| C. | 溶液中Na+的数目 | D. | 溶液的质量 |
| A. | 在不同温度下,以相同浓度相同体积的Na2S2O3与H2SO4反应来探究温度对化学反应速率的影响:3S2O32-+2SO42+10H+═6SO2↑+2S↓+5H2O | |
| B. | 酸性条件下,KI被O2氧化的离子方程式:4I-+O2+4H+═2I2+2H2O | |
| C. | 已知25℃、101kPa时,1molH2与溴蒸气完全反应生成气态HBr放出能量Q kJ,其热化学方程式为H2(g)+Br2(g)═2HBr(g)△H=-2Q kJ•mol-1 | |
| D. | 表示中和热的热化学方程式:2HCl(aq)+Ba(OH)2(aq)═BaCl2(aq)+2H2O(l)△H=-114.6 |