题目内容
1.下列说法正确的是( )| A. | 二氧化硅的结构式:O=Si=O | |
| B. | H2O沸点高于NH3,是因为H2O分子间存在氢键而NH3分子间不存在氢键 | |
| C. | 含有金属离子的晶体一定是离子晶体 | |
| D. | 分子晶体中一定存在分子间作用力,不一定存在共价键 |
分析 A.二氧化硅为原子晶体,晶体中不存在硅氧双键;
B.H2O、NH3分子间都存在氢键,相同物质的量,水中含有的氢键数目较多;
C.AlCl3晶体中含有金属元素,但是分子晶体;
D.分子晶体中一定存在分子间作用力,不一定存在共价键如惰性气体组成的晶体中不含化学键.
解答 解:A.由于二氧化硅为原子晶体,1个硅原子形成4个硅氧键,1个氧原子形成2个硅氧键,所以二氧化硅中不存在硅氧双键,故A错误;
B.O、N属于同周期元素,氧元素的非金属性强于氮元素,H2O、NH3分子间都存在氢键,但相同物质的量,水中含有的氢键数目较多,沸点较高,故B错误;
C.AlCl3晶体中含有金属元素,但以共价键结合,属于分子晶体,故C错误;
D.分子晶体中一定存在分子间作用力,惰性气体组成的晶体中不含化学键,只含有分子间作用力,故D正确;
故选D.
点评 本题考查二氧化硅的结构式、氢键、晶体与化学键的关系等,为高频考点,侧重于学生的理解能力的考查,题目难度中等,注意理清晶体类型和化学键的关系,为易错点.

练习册系列答案
相关题目
11.甲、乙两同学在实验室分别取用不同试剂来制取Al(OH)3 可选试剂有:AlCl3溶液、A12(SO4)3溶液、NaOH溶液、氨水.
(1)请完成下表:
(2)若是你来制取Al(OH)3,试剂组合还可以是氯化铝溶液和氨水或硝酸铝溶液和氨水.
(3)由甲、乙两同学的实验现象你能得出的结论有(用简要文字说明)实验室制取氢氧化铝最好选用可溶性铝盐和氨水,氢氧化铝可以和氢氧化钠溶液发生反应,和一水合氨不发生反应.
(1)请完成下表:
| 甲同学 | 乙同学 | |
| 选用试剂 | A1C13溶液、NaOH溶液 | A12(SO4)3溶液、氨水 |
| 操作 | 向AlCl3溶液中逐滴加入NaOH溶液至过量 | 向A12(SO4)3溶液中逐滴加入氨水至过量 |
| 实验现象 | 先产生白色沉淀,然后沉淀逐渐消失 | |
| 化学方程式 | AlCl3+3NaOH=Al(OH)3↓+3NaClAl(OH)3+NaOH=NaAlO2+2H2O | A12(SO4)3+6NH3•H2O═2A1(OH)3↓+3(NH4)2SO4 |
| 离子方程式 | Al3++3OH-=Al(OH)3↓ Al(OH)3+OH-=AlO2-+2H2O | Al3++3NH3•H2O=Al(OH)3↓+3NH4+ |
(3)由甲、乙两同学的实验现象你能得出的结论有(用简要文字说明)实验室制取氢氧化铝最好选用可溶性铝盐和氨水,氢氧化铝可以和氢氧化钠溶液发生反应,和一水合氨不发生反应.
12.对室温下pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,其中叙述正确的是( )
| A. | 分别加水稀释10倍,两溶液的pH仍相等 | |
| B. | 温度升高10℃,两溶液的pH均不变 | |
| C. | 加入适量的氯化铵晶体后,两溶液的pH均减小 | |
| D. | 用相同浓度的盐酸中和至反应完全时,消耗盐酸的体积相同 |
9.将5.36g Na2CO3•XH2O置于坩埚中加热至衡重时,质量减少3.24g,则x值为( )
| A. | 10 | B. | 3 | C. | 9 | D. | 6 |
6.解释下列反应原理的离子方程式正确的是( )
| A. | 用明矾作净水剂:Al3++3H2O═Al(OH)3↓+3H+ | |
| B. | 用小苏打治疗胃酸过多:CO32-+2H+═CO2↑+H2O | |
| C. | 用氯化铁溶液腐蚀印刷线路板上的铜:Fe3++Cu═Fe2++Cu2+ | |
| D. | 含等物质的量的KHCO3和Ba(OH)2溶液混合:HCO3-+Ba2++OH-═BaCO3↓+H2O |
10.下列说法正确的是( )
| A. | 由H原子形成1 mol H-H键要吸收热量 | |
| B. | 所有燃烧反应都是放热反应 | |
| C. | 在稀溶液中,1 mol酸与1 mol碱发生中和反应生成水时所释放的热量称为中和热 | |
| D. | 在一定条件下,1mol H2 与足量的Cl2、Br2、I2 分别反应,放出热量关系是I2>Br2>Cl2 |
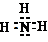 .
.


