题目内容
14.取不同质量的某种镁粉和铜粉的均匀混合物分别与相同浓度的盐酸充分反应,实验数据记录如表:| 实验序号 | (1) | (2) | (3) |
| 取用盐酸的体积/mL | 25 | 25 | 25 |
| 取用混合物的质量/g | 1.32 | 1.54 | 2.20 |
| 生成气体的体积(标准状况)/mL | 336 | 392 | 448 |
| A. | 1.2 | B. | 1.4 | C. | 1.6 | D. | 无法计算 |
分析 混合物中只有镁与盐酸发生反应:Mg+2HCl=MgCl2+H2↑,(1)、(2)、(3)三组所用盐酸的物质的量相同,随金属样品质量的增大,生成气体的体积增大,故(1)、(2)组中盐酸过量、样品中Mg完全反应.生成448mL氢气需要金属样品的质量为1.32g×=1.76g<2.20g,故(3)中盐酸完全反应,根据氢气的体积计算n(HCl),再根据c=计算该盐酸的物质的量浓度.
解答 解:混合物与盐酸发生反应:Mg+2HCl=MgCl2+H2↑,(1)、(2)、(3)三组所用盐酸的物质的量相同,随金属样品质量的增大,生成气体的体积增大,故(1)、(2)组中盐酸过量、样品中Mg完全反应.生成448mL氢气需要金属样品的质量为1.32g×=1.76g<2.20g,
则(3)中盐酸完全反应,生成氢气物质的量为:=0.02mol,
由H原子守恒可知25mL盐酸中含有氯化氢的物质的量为:n(HCl)=0.02mol×2=0.04mol,
所以该盐酸的物质的量浓度为:=1.6mol/L,
故选C.
点评 本题考查混合物计算、物质的量浓度计算,题目难度中等,试题侧重考查学生对实验数据的分析处理能力,判断盐酸是否完全反应是解题关键,注意掌握物质的量与物质的量浓度、摩尔质量之间的转化关系.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
5.如图所示是298K时N2与H2反应过程中,能量变化的曲线图.下列叙述正确的是( )
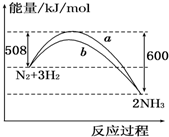

| A. | 该反应的热化学方程式为:N2+3H2?2NH3△H=-92 kJ/mol | |
| B. | a曲线是加入催化剂时的能量变化曲线 | |
| C. | 加入催化剂,该化学反应的反应热改变 | |
| D. | 在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
2.已知链式块毯C300经过适当处理可得含多个 (不含
(不含 )的链状化合物C300H298,则含
)的链状化合物C300H298,则含 的个数为( )
的个数为( )
 (不含
(不含 )的链状化合物C300H298,则含
)的链状化合物C300H298,则含 的个数为( )
的个数为( )| A. | 70 | B. | 72 | C. | 74 | D. | 76 |
9.下列反应中属于氧化还原反应,但不属于四种基本反应类型的是( )
| A. | CuO+H2Cu+H2O | B. | 2KMnO4K2MnO4+MnO2+O2↑ | ||
| C. | Fe2O3+3CO2Fe+2CO2 | D. | NaOH+HCl═NaCl+H2O |
 研究碳及其化合物的性质对于科研、生产生活具有重要意义.
研究碳及其化合物的性质对于科研、生产生活具有重要意义.
 .
.
 .
. 如图所示,
如图所示,