题目内容
19.向50mL 1.0mol/L的AlCl3溶液中加入60mL某浓度的NaOH溶液,得到1.56gAl(OH)3沉淀.则此NaOH溶液的物质的量浓度是1.0或3.0mol/L.分析 AlCl3的物质的量=0.05L×1.0mol/L=0.05mol,与NaOH反应完全转化为Al(OH)3,可得Al(OH)3为0.05mol,而得到1.56g即0.02mol Al(OH)3沉淀,由Al3++3OH-=Al(OH)3↓和Al(OH)3+OH-=AlO2-+2H2O可知,NaOH存在两种情况,一是NaOH不足,部分Al3+转化为Al(OH)3,二是Al3+全转化为Al(OH)3后,Al(OH)3部分溶解,以此计算.
解答 解:AlCl3的物质的量=0.05L×1.0mol/L=0.05mol,与NaOH反应完全转化为Al(OH)3,可得Al(OH)3为0.05mol,而得到1.56g即0.02mol Al(OH)3沉淀,则
一是NaOH不足,部分Al3+转化为Al(OH)3,则:
Al3++3OH-=Al(OH)3↓
0.06mol 0.02mol
故氢氧化钠溶液的物质的量浓度为$\frac{0.06mol}{0.06L}$=1.0mol/L;
二是Al3+全转化为Al(OH)3后,Al(OH)3部分溶解,则:
Al3++3OH-=Al(OH)3↓
0.05mol 0.15mol 0.05mol
Al(OH)3+OH-=AlO2-+2H2O,
(0.05-0.02)mol 0.03mol
故氢氧化钠溶液的物质的量浓度为$\frac{0.15mol+0.03mol}{0.06L}$=3.0mol/L,
故答案为:1.0或3.0.
点评 本题考查化学方程式的有关计算,根据沉淀的物质的量判断可能发生的反应是解题关键,侧重对学生的分析能力和计算能力的考查,题目难度中等.

练习册系列答案
相关题目
9.下列变化中,属于物理变化的是( )
| A. | 煤的干馏 | B. | 石油的分馏 | C. | 石油的裂化 | D. | 铝热反应 |
14.取不同质量的某种镁粉和铜粉的均匀混合物分别与相同浓度的盐酸充分反应,实验数据记录如表:
则该盐酸的物质的量浓度为(mol•L-1)( )
| 实验序号 | (1) | (2) | (3) |
| 取用盐酸的体积/mL | 25 | 25 | 25 |
| 取用混合物的质量/g | 1.32 | 1.54 | 2.20 |
| 生成气体的体积(标准状况)/mL | 336 | 392 | 448 |
| A. | 1.2 | B. | 1.4 | C. | 1.6 | D. | 无法计算 |
4.常温下,有0.1mol/L的①氯化铵、②氯化钠、③醋酸钠三种溶液.下列有关判断不正确的是( )
| A. | ①与②比较:c(Na+)>c(NH4+) | |
| B. | ①中的离子浓度的大小关系是:c(Cl-)>c(NH4+)>c(H+)>c(OH-) | |
| C. | ①与②等体积混合的溶液中:c(Cl-)=c(NH4+)+c(Na+)+c(NH3•H2O) | |
| D. | 向③中加入适量醋酸溶液,使溶液pH=7,则:c(CH3COO-)>(Na+) |
11.直接由原子构成的一组物质是( )
| A. | 干冰、二氧化硅、金刚石 | B. | 氧化钠、金刚石、氯化氢 | ||
| C. | 碘、石墨、氯化钠 | D. | 二氧化硅、金刚石、晶体硼 |
9.下列事实,不能用勒夏特列原理解释的是( )
| A. | 溴水中有平衡:Br2+H2O?HBr+HBrO 加入AgNO3溶液后,溶液颜色变浅 | |
| B. | 合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 | |
| C. | 高压比常压有利于合成SO3的反应 | |
| D. | 对CO(g)+NO2(g)?CO2(g)+NO(g) 平衡体系增大压强可使颜色变深 |
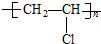
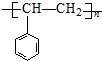
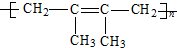
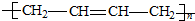
 ,属于取代反应.
,属于取代反应.