题目内容
6.已知 H2+O2$\stackrel{点燃}{→}$ H2O,关于该反应正确的是( )| A. | 分子的稳定性与化学键的强弱无关 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成水的总能量 | |
| C. | 断开参加反应的氢气和氧气中的化学键吸收的能量大于生成水时形成化学键放出的能量 | |
| D. | 该反应需要点燃,所以是吸热反应 |
分析 A.当物质发生变化时,存在化学键的断裂或生成;
B.反应物总能量高于生成物,反应放热;
C.反应中断裂化学键吸收的能量低于形成化学键放出的能量,反应放热;
D.氢气在氧气中燃烧是放热反应.
解答 解:A.当物质发生变化时,存在化学键的断裂或生成,与化学键有关,故A错误;
B.反应是放热反应,依据反应前后能量守恒得到,反应物总能量高于生成物,故B正确;
C.反应是放热反应,所以反应中断裂化学键吸收的能量低于形成化学键放出的能量,故C错误;
D.氢气在氧气中点燃发生燃烧,是放热反应,故D错误.
故选B.
点评 本题考查了化学反应能量变化分析,主要是能量守恒和反应实质的理解应用,题目较简单.

练习册系列答案
相关题目
16.ClO-、ClO2-、ClO3-、ClO4-中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构
| 微粒 | ClO- | ClO2- | ClO3- | ClO4- |
| 立体结构 | 直线 | V型 | 三角锥形 | 正四面体 |
11.已知C5H11Cl共有8种同分异构体,可推知分子式为C5H12O属于醇类的同分异构体的数目共有( )
| A. | 9种 | B. | 6 种 | C. | 5种 | D. | 8种 |
15.下列热化学方程式中的反应热下划线处表示燃烧热的是( )
| A. | A.NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
16. 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)已知2molNO完全转化放出akJ热量,若将2molNO 和2molCO放入容器中反应,放出0.8akJ热量,则产生N2的物质的量为0.8mol.
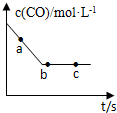
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c)
②下列可说明反应到达图中c点的是BC
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
①实验编号Ⅱ的实验目的为探究催化剂比表面积对反应速率的影响.
【结论】
②由表中数据可知,升高温度,反应速率将增大.(填“增大”、“减小”、“无影响”).
 汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:
汽车排放的尾气为大气污染源之一,目前,可利用以下化学原理解决尾气:2NO+2CO$\stackrel{催化剂}{?}$2CO2+N2.
(1)已知2molNO完全转化放出akJ热量,若将2molNO 和2molCO放入容器中反应,放出0.8akJ热量,则产生N2的物质的量为0.8mol.
(2)一定条件下,在容积固定的容器中进行上述反应,CO浓度与时间关系如图所示:
①则反应速率υ(a)、υ(b)、υ(c)的大小关系是υ(a)>υ(b)=υ(c)
②下列可说明反应到达图中c点的是BC
A.NO、CO、CO2、N2的浓度比值保持2:2:2:1不变
B.CO的浓度不再改变
C.反应消耗2molNO的同时消耗1molN2
(3)为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究.
【资料查阅】
A.不同的催化剂对同一反应的催化效率不同;
B.使用等质量相同的催化剂时,催化剂的比表面积对催化效率有影响.
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验.
| 实验编号 | 实验目的 | T/℃ | NO初始浓度 mol/L | CO初始浓度 mol/L | 同种催化剂的比表面积 m2/g | 达平衡时所用的时间min |
| Ⅰ | 参照实验 | 280 | 6.50×10-3 | 4.00×10-3 | 80 | t |
| Ⅱ | 280 | 6.50×10-3 | 4.00×10-3 | 120 | 0.5t | |
| Ⅲ | 探究温度对反应速率的影响 | 360 | 6.50×10-3 | 4.00×10-3 | 80 | 0.2t |
【结论】
②由表中数据可知,升高温度,反应速率将增大.(填“增大”、“减小”、“无影响”).
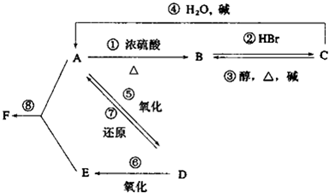 某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A.它们的转化关系如图:
某有机物A,由C、H、O三种元素组成,在一定条件下,由A可以转化为有机物B、C和D、E;C又可以转化为B、A.它们的转化关系如图: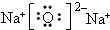 .
.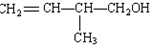
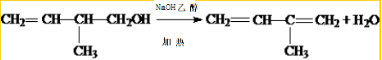 .
.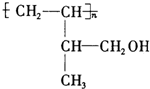 .
.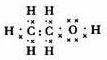 ;
;