题目内容
15.下列热化学方程式中的反应热下划线处表示燃烧热的是( )| A. | A.NH3(g)+$\frac{5}{4}$O2(g)═NO(g)+$\frac{6}{4}$H2O(g);△H=-akJ•mol-1 | |
| B. | C6H12O6(s)+6O2(g)═6CO2(g)+6H2O(l);△H=-bkJ•mol-1 | |
| C. | 2CO(g)+O2(g)═2CO2(g);△H=-ckJ•mol-1 | |
| D. | CH3CH2OH(l)+$\frac{1}{2}$O2(g)═CH3CHO(l)+H2O(l);△H=-dkJ•mol-1 |
分析 依据燃烧热的概念分析判断,燃烧热是指1mol可燃物完全燃烧生成稳定氧化物时放出的热量.
解答 解:A.热化学方程式中的水是气体,不是最稳定的氧化物,故A错误;
B.1molC6H12O6(s)完全燃烧生成了稳定的氧化物二氧化碳和液态水,符合燃烧热的概念,故B正确;
C.热化学方程式中是2mol可燃物一氧化碳反应放出的热量,故C错误;
D.乙醇的催化氧化反应生成的乙醛还可以燃烧,不符合燃烧热的概念,故D错误;
故选B.
点评 本题考查了燃烧热的概念应用,主要是在热化学方程式中的判断和分析,题目难度不大.

练习册系列答案
相关题目
5.把下列物质分别加入(或通入)溴水中,不会褪色的是( )
| A. | 苯 | B. | 乙烯 | C. | 乙醇 | D. | KMnO4溶液 |
6.已知 H2+O2$\stackrel{点燃}{→}$ H2O,关于该反应正确的是( )
| A. | 分子的稳定性与化学键的强弱无关 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成水的总能量 | |
| C. | 断开参加反应的氢气和氧气中的化学键吸收的能量大于生成水时形成化学键放出的能量 | |
| D. | 该反应需要点燃,所以是吸热反应 |
3.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 常温常压下,7.0g乙烯与丙烯的混合物中含有氢原子的数目为NA | |
| B. | 常温常压下,22.4 L CH4中含有的C-H键数为4NA | |
| C. | 含0.2 mol H2SO4的浓硫酸与足量Cu反应,生成SO2的分子数为0.1NA | |
| D. | lmol FeCl2与足量氯气反应时转移的电子数为2NA |
4.下列化合物,既能与强酸反应,又能与强碱溶液反应的是( )
①Al(OH)3 ②NaHCO3 ③(NH4)2S ④NaHSO4.
①Al(OH)3 ②NaHCO3 ③(NH4)2S ④NaHSO4.
| A. | 只有① | B. | ①和② | C. | ①②③ | D. | ①②③④ |
5.元素X和Y的原子序数都小于18,两者能组成化合物XY3.已知X的原子序数为n,则Y的原子序数不可能是( )
| A. | n+3 | B. | n-4 | C. | n-6 | D. | n-8 |
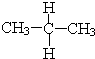 与
与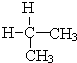 ⑦CH3CH3与
⑦CH3CH3与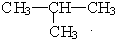
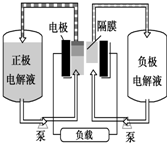 全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟.
全钒液流电池是一种活性物质呈循环流动液态的电池,目前钒电池技术已经趋近成熟. +3HNO3 $→_{△}^{浓硫酸}$
+3HNO3 $→_{△}^{浓硫酸}$ +3H2O.
+3H2O.