题目内容
16.ClO-、ClO2-、ClO3-、ClO4-中Cl都是以sp3杂化轨道与O原子成键的,试推测下列微粒的立体结构| 微粒 | ClO- | ClO2- | ClO3- | ClO4- |
| 立体结构 | 直线 | V型 | 三角锥形 | 正四面体 |
分析 根据价层电子对互斥理论来确定其空间构型,价层电子对个数=σ键个数+孤电子对个数=4,Cl是以sp3杂化轨道与O原子成键.
解答 解:次氯酸根离子中只含一个氯原子和一个氧原子,所以是直线型;
ClO2-中价层电子对个数=2+$\frac{1}{2}$(7+1-2×2)=2,且含有2个孤电子对,所以是V型;
ClO3-中价层电子对个数=3+$\frac{1}{2}$(7+1-3×2)=4,且含有一个孤电子对,所以是三角锥型;
ClO4-中价层电子对个数=4+$\frac{1}{2}$(7+1-4×2)=4,且不含孤电子对,所以是正四面体型,
故答案为:直线;V型;三角锥型;正四面体.
点评 本题考查了微粒的空间构型,根据价层电子对互斥理论确定其空间构型,注意孤电子对的确定方法,题目难度不大.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
6.重金属元素铬的毒性较大,含铬废水需经处理达标后才能排放.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:
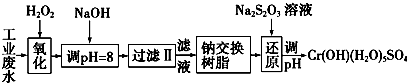
注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
(1)氧化过程中可代替H2O2加入的试剂是A(填序号).
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
Ⅰ.某工业废水中主要含有Cr3+,同时还含有少量的Fe3+、Al3+、Ca2+和Mg2+等,且酸性较强.为回收利用,通常采用如下流程处理:

注:部分阳离子常温下以氢氧化物形式完全沉淀时溶液的pH见下表.
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Mg(OH)2 | Al(OH)3 | Cr(OH)3 |
| pH | 3.7 | 9.6 | 11.1 | 8 | 9(>9溶解) |
A.Na2O2 B.HNO3 C.FeCl3 D.KMnO4
(2)加入NaOH溶液调整溶液pH=8时,除去的离子是AB;已知钠离子交换树脂的原理:Mn++nNaR-→MRn+nNa+,此步操作被交换除去的杂质离子是CD.
A.Fe3+ B.Al3+ C.Ca2+ D.Mg2+
(3)还原过程中,每消耗0.8mol Cr2O72-转移4.8mol e-,该反应离子方程式为3S2O32-+4Cr2O72-+26H+═6SO42-+8Cr3++13H2O.
Ⅱ.酸性条件下,六价铬主要以Cr2O72-形式存在,工业上常用电解法处理含Cr2O72-的废水:
该法用Fe作电极电解含Cr2O72-的酸性废水,随着电解进行,在阴极附近溶液pH升高,产生Cr(OH)3溶液.
(1)电解时能否用Cu电极来代替Fe电极?不能(填“能”或“不能”),理由是因阳极产生的Cu2+不能使Cr2O72-还原到低价态.
(2)电解时阳极附近溶液中Cr2O72-转化为Cr3+的离子方程式为Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O.
(3)常温下,Cr(OH)3的溶度积Ksp=1×10-32,溶液的pH应为5时才能使c(Cr3+)降至10-5 mol•L-1.
8.由1,3丁二烯合成氯丁橡胶的过程中,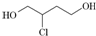 是一种中间产物.下列说法正确的是( )
是一种中间产物.下列说法正确的是( )
 是一种中间产物.下列说法正确的是( )
是一种中间产物.下列说法正确的是( )| A. | 1,3丁二烯分子式为C4H8 | |
| B. | 1,3丁二烯转化为 时,先与Cl2发生1,4加成再水解得到 时,先与Cl2发生1,4加成再水解得到 | |
| C. |  在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应 在NaOH醇溶液中或浓硫酸存在时加热都能发生消去反应 | |
| D. |  催化氧化得X,X能发生银镜反应,则X的结构只有两种 催化氧化得X,X能发生银镜反应,则X的结构只有两种 |
5.把下列物质分别加入(或通入)溴水中,不会褪色的是( )
| A. | 苯 | B. | 乙烯 | C. | 乙醇 | D. | KMnO4溶液 |
6.已知 H2+O2$\stackrel{点燃}{→}$ H2O,关于该反应正确的是( )
| A. | 分子的稳定性与化学键的强弱无关 | |
| B. | 参加反应的氢气和氧气的总能量高于反应生成水的总能量 | |
| C. | 断开参加反应的氢气和氧气中的化学键吸收的能量大于生成水时形成化学键放出的能量 | |
| D. | 该反应需要点燃,所以是吸热反应 |
 如图是常见原电池装置,电流表G发生偏转:
如图是常见原电池装置,电流表G发生偏转: