题目内容
1.某化学实验小组的同学对铜与硝酸反应的实验及铜的设备、回收利用进行了下列几方面的研究.Ⅰ图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置:

(1)甲、乙、丙三个装置中共同发生的离子方程式是Cu+4H++2NO3-=Cu2++2NO2↑+2H2O.
(2)和甲装置相比,乙装置的优点是①可以控制反应;②吸收NO2气体,防止污染环境.
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置,检查丙装置是否漏气的方法是打开abc,用手捂住试管①,若两个烧杯中均有气泡冒出,松开手后,插入两烧杯中的导管内有倒吸的水柱形成,则气密性良好.实验时先关闭弹簧夹c,再打开弹簧夹ab,才能使CO2气体充满试管②.
(4)在做铜与稀硝酸反应的实验时,常看到生成的气体为浅红棕色,其原因是2NO+O2=2NO2(用方程式表示),为了能直接观察到生成气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐即可达到目的,那么加入碳酸盐的作用是碳酸盐与硝酸的反应速率快,生成的CO2排走了试管内的空气.
Ⅱ(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2
湿法炼铜:CuSO4+Fe═FeSO4+Cu
上述两种方法中,铜元素均被还原(填“氧化”还是“还原”)成铜单质.
(2)可用FeCl3溶液浸泡印刷电路板上的铜制备CuCl2•2H2O,实验室模拟回收过程如下:

加试剂1

①步骤3的目的是使溶液的pH升高到5,此时Fe3+浓度为4×10-11mol/L[Ksp(Fe(OH)3)=4×10-38],可选用的试剂1是CuO或Cu(OH)2(写出一种即可).
②欲实现反应Cu+H2SO4(aq)=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”).

分析 Ⅰ、(1)铜与浓硝酸的反应生成二氧化氮和硝酸铜;
(2)根据甲乙两个装置的不同点分析;
(3)检验装置的气密性,应该先形成密闭容器,再根据气体的热胀冷缩原理操作;
(4)铜和稀硝酸 反应生成硝酸铜、一氧化氮和水;观察到试管内生成的气体先为浅红棕色是因为试管中含有空气,一氧化氮被氧气氧化为红棕色气体二氧化氮;加入碳酸盐会和硝酸反应生成二氧化碳气体把试管中空气赶净,便于观察生成的无色一氧化氮气体;
Ⅱ、(1)元素化合价降低被还原,铜元素化合价降低为0价;
(2)①根据pH升高,溶液的酸性减弱,加入的物质能与酸反应,同时不能引入新杂质;
②Cu和H2SO4之间的反应是非自发的,需要电解池实现,根据电解池的构成条件来回答.
解答 解:Ⅰ、(1)甲、乙、丙三个装置中共同的一个反应是浓硝酸与铜片反应或是浓硝酸与铜丝反应,即Cu+4H++2NO3-=Cu2++2NO2↑+2H2O,
故答案为:Cu+4H++2NO3-=Cu2++2NO2↑+2H2O;
(2)甲、乙两个装置的差异在于:甲装置铜与浓硝酸反应使用的是铜片直接与浓硝酸反应,而乙装置则是可移动的铜丝与浓硝酸反应,其优点为便于控制,需要时插入酸液就反应,不需要时从酸液中移出即可;甲装置没有处理NO2污染的装置,而乙装置用氢氧化钠溶液吸收产生的NO2,能防止空气污染.
故答案为:①可以控制反应;②吸收NO2气体,防止污染环境;
(3)打开abc,使整个装置连通,用手捂住试管①给试管加热,气体受热体积膨胀,则两个烧杯中均有气泡冒出,松开手后,气体体积缩小,装置中的压强减小,则插入两烧杯中的导管内有倒吸的水柱形成,说明装置的气密性良好;要使NO2充满试管②,就不能让NO2进入烧杯中与水反应,即必须关闭弹簧夹c,且打开弹簧夹ab,使NO2经过试管②,利用NO2的密度比空气大来用向上排空气法收集NO2;
故答案为:打开abc,用手捂住试管①,若两个烧杯中均有气泡冒出,松开手后,插入两烧杯中的导管内有倒吸的水柱形成,则气密性良好;c,ab;
(4)铜和稀硝酸 反应生成硝酸铜、一氧化氮和水,反应的离子方程式为:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O;观察到试管内生成的气体先为浅红棕色是因为试管中含有空气,一氧化氮被氧气氧化为红棕色气体二氧化氮,2NO+O2=2NO2;加入碳酸盐会和硝酸反应生成二氧化碳气体把试管中空气赶净,便于观察生成的无色一氧化氮气体;
故答案为:2NO+O2=2NO2; 碳酸盐与硝酸的反应速率快,生成的CO2排走了试管内的空气;
Ⅱ、(1)火法炼铜:Cu2S+O2$\frac{\underline{\;高温\;}}{\;}$2Cu+SO2,湿法炼铜:CuSO4+Fe═FeSO4+Cu,铜元素化合价从+1、+2价反应后变化为0价,铜元素的化合价降低,Cu2S、CuSO4都为氧化剂,被还原,发生还原反应,
故答案为:还原;
(2)①pH升高,溶液的酸性减弱,加入的物质能与酸反应,同时不能引入新杂质,可向溶液中加入CuO或Cu(OH)2,故答案为:CuO或Cu(OH)2;
②Cu和H2SO4之间的反应是非自发的,需要电解池实现,金属铜作阳极,阴极是导体即可,电解质为硫酸,即 ,
,
故答案 .
.
点评 本题把实验知识与浓硝酸的性质、二氧化氮的性质、喷泉实验的发生等结合一起,具有很强的综合性,因而难度较大,需要细心审题,认真分析,侧重于考查学生的实验能力和对基础知识的综合应用能力.

 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案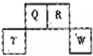 短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,下列说法正确的是( )| A. | W在周期表中的位置是第三周期,ⅤA族 | |
| B. | 原子半径Q>R>T | |
| C. | W原子得电子能力强于Q原子,且可形成共价化合物QW2 | |
| D. | 原子序数比R多1的元素只有一种氢化物 |
| A. | 28Si、29Si、30Si是同素异形体 | |
| B. | 自然界里存在大量的单质硅、二氧化硅和硅酸盐 | |
| C. | 硅和锗都是重要的半导体材料 | |
| D. | 二氧化硅既溶于氢氧化钠溶液又溶于氢氟酸,所以二氧化硅是两性氧化物 |
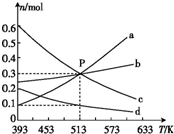 在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )
在1L恒容密闭容器中,发生反应:2CO2(g)+6H2(g)?C2H4(g)+4H2O(g)△H,平衡时各物质的物质的量与温度的关系如图所示,下列说法正确的是( )| A. | △H<0 | |
| B. | 图中曲线a表示H2(g)的变化 | |
| C. | P点时,平衡常数值约为333.3 | |
| D. | 513 K时,向上述容器中充入n(H2)=0.6 mol,n(CO2)=0.2 mol,n(C2H4)=0.6 mol,n(H2O)=0.6 mol,则达到平衡时氢气的体积分数比P点时的小 |
| A. | 金属钠在氯气中燃烧会产生大量棕黄色烟 | |
| B. | 钠的化学性质活泼,可从CuSO4溶液中置换出Cu | |
| C. | 钠着火时可以用沙土盖灭 | |
| D. | 钠在空气中燃烧,生成氧化钠 |
 ,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.
,B原子L层的电子总数是K层的3倍;0.1mol C单质能从酸中置换出2.24L氢气(标准状况),同时它的电子层结构变得与氖原子的电子层结构相同;D离子的半径比C离子的小,D离子与B离子的电子层结构相同.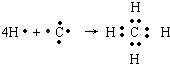 .
.