题目内容
11.下列关于钠的说法正确的是( )| A. | 金属钠在氯气中燃烧会产生大量棕黄色烟 | |
| B. | 钠的化学性质活泼,可从CuSO4溶液中置换出Cu | |
| C. | 钠着火时可以用沙土盖灭 | |
| D. | 钠在空气中燃烧,生成氧化钠 |
分析 A.钠在氯气中燃烧产生白烟;
B.钠性质很活泼,先和硫酸铜溶液中的水反应,然后生成的NaOH再和硫酸铜发生复分解反应;
C.钠在空气中剧烈燃烧生成过氧化钠,过氧化钠和钠都与水反应,钠着火时灭火要隔绝空气和水;
D.钠在空气中燃烧生成过氧化钠.
解答 解:A.钠在氯气中燃烧产生白烟,金属Cu在氯气中燃烧会产生大量棕黄色烟,故A错误;
B.钠性质很活泼,先和硫酸铜溶液中的水反应,然后生成的NaOH再和硫酸铜发生复分解反应,所以钠投入硫酸铜溶液中得不到Cu,故B错误;
C.钠在空气中剧烈燃烧生成过氧化钠,过氧化钠和钠都与水反应,钠着火时灭火要隔绝空气和水,所以可以用沙土覆盖,故C正确;
D.钠在空气中燃烧生成过氧化钠,钠和氧气接触生成氧化钠,故D错误;
故选C.
点评 本题考查元素化合物性质,涉及实验现象、生成物成分等知识点,注意:反应物相同反应条件不同会导致产物不同,易错选项是B.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
2.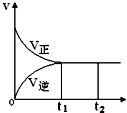 可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )
可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )
 可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )
可逆反应N2(g)+3H2(g)?2NH3(g),正反应为放热反应,在一密闭容器中进行,如图是该过程中的反应速率(v)与时间(t)的关系曲线,下列叙述错误的是( )| A. | t1~t2,各物质的浓度不再发生变化 | |
| B. | t2时刻升高温度,反应物转化率不会改变 | |
| C. | t2时刻增大N2的浓度,可提高H2的转化率 | |
| D. | 使用催化剂可加快反应速率,提高生产效率 |
19.设阿伏加德罗常数的数值为NA,下列说法正确的是( )
| A. | 2.3 g Na和足量的O2完全反应,生成3.4g固体混合物,转移电子数为0.1NA | |
| B. | 电解精炼铜时,当阳极减少64g金属时转移的电子数为2NA | |
| C. | 46 g的NO2与46 g的N2O4含有的原子数不同 | |
| D. | 标准状况下,11.2 L苯中含有碳碳双键数目为3NA |
16.下列说法正确的是( )
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,则△H<0 | |
| B. | 铁片镀锌时,铁片与外电源的正极相连 | |
| C. | 以熔融Al2O3为电解质进行电解冶炼铝,熔融体中Al3+向阳极移动 | |
| D. | t℃时,恒容密闭容器中反应:NO2(g)+SO2(g)?NO(g)+SO3(g),通入少量O2,$\frac{c(NO).c(S{O}_{3})}{c(N{O}_{2}).c(S{O}_{2})}$的值及SO2转化率不变 |
3.下列离子方程式表达正确的是( )
| A. | 用惰性电极电解熔融氯化钠:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$Cl2↑+H2↑+2OH- | |
| B. | 用氢氧化钠溶液除去铝表面的氧化膜:Al2O3+2OH-+3H2O═2[Al(OH)4]- | |
| C. | 向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO${\;}_{3}^{-}$+Ca2++2OH-═CaCO3↓+CO${\;}_{3}^{2-}$+2H2O | |
| D. | 用食醋除去水瓶中的水垢:CO${\;}_{3}^{2-}$+2CH3COOH═2CH3COO-+CO2↑+H2O |
1.下列事实不能用勒夏特列原理解释的是( )
| A. | 新制的氯水在光照条件下颜色变浅 | |
| B. | 饱和NaCl溶液中通入HCl气体有晶体析出 | |
| C. | 500℃左右比室温更有利于合成氨反应 | |
| D. | 滴有酚酞试液的氨水中加入少量醋酸铵晶体,溶液红色变浅 |