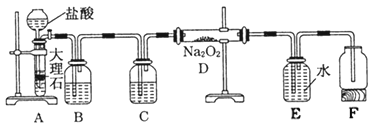
题目内容
【题目】(一)、 一定条件下,将SO2和O2充入一密闭容器中,发生如下反应:2SO2(g)+O2(g)![]() 2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:
2SO3(g)(正反应放热)反应过程中SO2、O2、SO3物质的量变化如图所示:回答下列问题:

(1)降低温度,SO2的转化率_________,化学反应速度_________。(填“增大”“减小”或“不变”)
(2)反应处于平衡状态的时间是_________。
(3)反应进行至20 min时,曲线发生变化的原因是______________________(用文字表达)。10 min到15 min的曲线变化的原因可能是_________(填写编号)。
a. 加了催化剂 b. 缩小容器体积
c. 降低温度 d. 增加SO3的物质的量
(二) 在一个固定体积的密闭容器中,充入 2 mol A 和1 mol B,发生如下反应:2 A(g) + B(g)![]() 3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
3C(g) + D(s), 反应达到平衡时 C的浓度为1.2 mol/L。
(1)若使容器温度升高,平衡时混合气体的平均相对摩尔质量减小,则正反应为_____反应(填“吸热”或“放热”)反应。
(2)若维持容器体积和温度不变,按下列方法加入起始物质,达到平衡时C的浓度仍为1.2 mol/L的是____________(用序号填空)
① 4 mol A + 2 mol B ② 3 mol C + 1 mol D + 1 mol B
③ 3 mol C + 2 mol D ④ 1.6 mol A + 0.8 mol B + 0.6 mol C
【答案】增大 减小 15~20 min,25~30 min 增加了O2的量 ab 吸热 ③
【解析】
(一)(1)该反应正反应为放热反应,降低温度平衡向正反应方向移动,二氧化硫转化率增大,降低温度反应速率减小,故答案为:增大;减小;
(2)反应混合物各物质的物质的量不变化,说明反应处于平衡状态,由图可知在15-20min和25-30min出现平台,各组分的物质的量不变,反应处于平衡状态,故答案为:15-20min和25-30min;
(3)由图可知,反应进行至20 min时,氧气的浓度突然增大,二氧化硫和三氧化硫的浓度不变,说明改变的条件是增加了O2的量;由图可知,反应向正反应方向进行,10min到15min反应混合物单位时间内的物质的量的变化量增大,说明反应速率增大,10min改变瞬间,各物质的物质的量不变。a.加了催化剂,增大反应速率,故a正确;b.缩小容器体积,增大压强,增大反应速率,故b正确;c.降低温度反应速率降低,故c错误;d.10min改变瞬间,各物质的物质的量不变,不是增加SO3的物质的量,故d错误;故选ab;故答案为:增加了O2的量;ab;
(二)(1)根据质量守恒定律及反应方程式知,2 A(g) + B(g)![]() 3C(g) + D(s)反应前后气体的物质的量不变,气体的质量变小,所以平均摩尔质量减小,温度升高,平衡时混合气体的平均相对摩尔质量减小,说明平衡向正反应方向移动,所以正反应是吸热反应,故答案为:吸热;
3C(g) + D(s)反应前后气体的物质的量不变,气体的质量变小,所以平均摩尔质量减小,温度升高,平衡时混合气体的平均相对摩尔质量减小,说明平衡向正反应方向移动,所以正反应是吸热反应,故答案为:吸热;
(2)维持容器体积和温度不变,根据等效平衡,把物质都换算成方程式一边的物质,且和初始加入的入2molA和1molB相等即可。①4molA+2molB与初始A、B的物质的量不同,故错误;②3molC+lmolD+1molB换算成A、B,A、B的物质的量分别为2mol、2mol,与A、B的初始物质的量不同,故错误;③3molC+2molD换算成A、B,A、B的物质的量分别为2mol、1mol,D是固体,对气体无影响,与A、B的初始物质的量相同,故正确;④1.6molA+0.8 molB+0.6mol C换算成A、B,与A、B的初始物质的量不同,故错误;故答案为:③。

 口算题天天练系列答案
口算题天天练系列答案【题目】(一)在密闭容器中,保持一定温度进行如下反应:N2(g)+3H2(g) ![]() 2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
2NH3(g),已知加入1 mol N2和3 mol H2,在恒压条件下达到平衡时生成a mol NH3,在恒容条件下达到平衡时生成b mol NH3,回答下列问题:
(1)写出该反应的化学平衡常数表达式:K=___________。
(2)平衡常数K值越大,表明建立平衡时___________(填序号)。
A. N2的转化率越高 B. NH3的产量越大
C. 正反应进行得越彻底 D. 化学反应速度越快
(3)a与b的关系是:a ____ b(填>、<、=)
(二)在密闭容器中发生下列反应: I2(g)+H2(g)![]() 2HI(g)(正反应吸热)
2HI(g)(正反应吸热)
起始时,n(H2)=a mol,n(I2)=b mol。只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”“减小”或“不变”)填入相应的表格。
编号 | 反应条件 | 反应速率 |
① | 升高温度 | ______ |
② | 再充入a mol H2 | _______ |
③ | 将容器容积扩大为原来2倍 | _______ |
④ | 容积不变通入b mol Ne(g) | _______ |