题目内容
已知: (1)NH3(g)+HCl(g)=NH4Cl(s); △H1=-76kJ·mol-1
(2)NH3(g)+H2O(l)=NH3·H2O(aq); △H2=-35.1kJ·mol-1
(3)HCl(g)+HCl (aq); △H3=-72.3kJ·mol-1
(4)HCl (aq) NH3·H2O(aq) =NH4Cl(aq)+H2O(l); △H4=-52.3kJ·mol-1
(5)NH4Cl(s)=NH2Cl(aq); △H5=?
根据盖斯定律,则(5)方程式中的反应热△H5为
| A.-335.7 kJ·mol-1 | B.-16.3 kJ·mol-1 |
| C.+16.3 kJ·mol-1 | D.-83.7 kJ·mol-1 |
D
解析试题分析:分析已知方程式,利用(2)+(3)+(4)-(1)得目标方程式,结合盖斯定律,可得该方程式的△H="-83.7" kJ/mol,正确。
考点:考查盖斯定律,考查考生对盖斯定律灵活运用的能力。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案在298 K、100 kPa时,已知:
2H2O(g)=O2(g)+2H2(g);ΔH1
Cl2(g)+H2(g)=2HCl(g);ΔH2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g);ΔH3
则ΔH3与ΔH1和ΔH2间的关系正确的是
| A.ΔH3=ΔH1+2ΔH2 | B.ΔH3=ΔH1+ΔH2 |
| C.ΔH3=ΔH1-2ΔH2 | D.ΔH3=ΔH1-ΔH2 |
SF6是一种优良的绝缘气体,分子结构中存在S-F键。已知S8(s)的分子结构模型(如图),断裂1molS—S、1molF—F 、1molS—F键需吸收的能量分别为280kJ 、160kJ、330kJ.则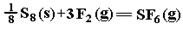 :的反应热ΔH为 ( )
:的反应热ΔH为 ( )
| A.-1780kJ·mol-1 | B.-1220kJ·mol-1 | C.-450kJ·mol-1 | D.+430kJ·mol-1 |
已知:⑴H2(g) + 0.5O2(g) =H2O(g) △H1=a kJ/mol, ⑵2H2(g) + O2(g) = 2H2O(g)△H2=b kJ/mol,⑶H2(g) + 0.5O2(g) =H2O(l) △H3=c kJ/mol
⑷2H2(g) + O2(g) = 2H2O(l) △H4=d kJ/mol,下列关系式中正确的是
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
下列对有关反应能量变化图像的判断错误的是( )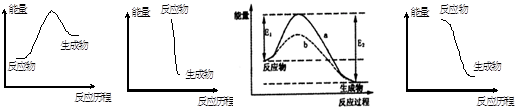
I Ⅱ Ⅲ Ⅳ
| A.I可表示需加热的放热反应 |
| B.Ⅱ可表示爆炸反应 |
| C.Ⅲ可表示无催化剂(a)和有催化剂(b)时反应的能量变化 |
| D.Ⅳ可表示醋酸和碱的中和反应 |
某一化学反应在不同条件下的能量变化曲线如图所示。下列说法正确的是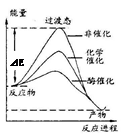
| A.化学催化比酶催化的效果好 |
| B.使用不同催化剂可以改变反应的热效应 |
| C.使用不同催化剂可以改变反应的能耗 |
| D.反应物的总能量低于生成物的总能量 |
根据碘与氢气反应的热化学方程式
(i)I2(g)+ H2(g)  2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g)
2HI(g)+ 9.48 kJ (ii) I2(s)+ H2(g) 2HI(g) - 26.48 kJ
2HI(g) - 26.48 kJ
下列判断正确的是
| A.1mol I2(s)中通入2gH2(g),反应吸热26.48 kJ |
| B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ |
| C.反应(ii)的反应物总能量比反应(i)的反应物总能量低 |
| D.反应(i)放出的热量多,所以产物的能量低,比反应(ii)的产物更稳定 |
参照反应Br + H2 HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的
HBr +H的能量对反应历程的示意图,下列对上述正反应叙述中正确的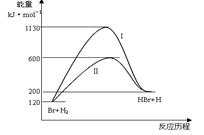
| A.反应热:过程I>过程Ⅱ |
| B.反应速率:过程Ⅱ=过程I |
| C.该反应为吸热反应 |
| D.过程I使用了催化剂 |
下列变化中生成物的总能量大于反应物的总能量的是( )
| A.H + H = H—H | B.H—Cl =" H" + Cl |
| C.Mg + 2HCl = MgCl2 + H2 ↑ | D.H2SO4 + 2NaOH = Na2SO4 + 2H2O |