题目内容
下列关于燃烧热和中和热的比较中,错误的是
| A.两者对应反应的△H均小于0 |
| B.两者的单位均为kJ·mol-1,但mol-1的含义不同 |
| C.两者的数值均不随反应物用量改变而改变 |
| D.两者的数值均随反应物改变而改变 |
D
解析试题分析:A.燃烧热和中和热均是放热反应,△H均小于0,正确;B.方程式系数不同,mol-1的含义不同;正确C.两者的数值均随反应物用量改变而改变,错误。D.正确。
考点:燃烧热 、中和热

练习册系列答案
相关题目
为了测定酸碱中和反应的中和热,计算时至少需要的数据是
①酸的浓度和体积 ②碱的浓度和体积 ③比热容 ④反应后溶液的质量
⑤生成水的物质的量 ⑥反应前后溶液温度变化 ⑦操作所需的时间
| A.①②③⑥ | B.①③④⑥ | C.③④⑤⑥ | D.全部 |
下列关于热化学反应的描述中正确的是
| A.HCl和NaOH反应的中和热△H=-57.3kJ/mol,则H2SO4和Ca(OH)2反应的中和热△H=2×(-57.3)kJ/mol |
| B.1mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
| C.需要加热才能发生的反应一定是吸热反应 |
| D.CO(g)的燃烧热是283.0kJ/mol,则2CO2(g) =2CO(g)+O2(g)反应的△H=2×283.0kJ/mol |
已知:⑴H2(g) + 0.5O2(g) =H2O(g) △H1=a kJ/mol, ⑵2H2(g) + O2(g) = 2H2O(g)△H2=b kJ/mol,⑶H2(g) + 0.5O2(g) =H2O(l) △H3=c kJ/mol
⑷2H2(g) + O2(g) = 2H2O(l) △H4=d kJ/mol,下列关系式中正确的是
| A.a<c<0 | B.b>d>0 | C.2a=b<0 | D.2c=d>0 |
下列说法中错误的是
| A.电解饱和食盐水,生成物总能量比反应物总能量高 |
| B.能自发进行的化学反应,不一定是△H<0,△S>0 |
| C.“冰,水为之,而寒于水”,说明相同质量的水和冰,水的能量高 |
| D.食盐可用于融化冰雪,且用食盐作融雪剂不会对环境、植物生长产生任何危害 |
某一化学反应在不同条件下的能量变化曲线如图所示。下列说法正确的是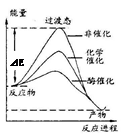
| A.化学催化比酶催化的效果好 |
| B.使用不同催化剂可以改变反应的热效应 |
| C.使用不同催化剂可以改变反应的能耗 |
| D.反应物的总能量低于生成物的总能量 |
如图为某烯烃在催化剂作用下发生加成反应的能量变化图,下列有关叙述错误的是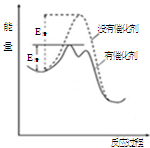
| A.催化剂能降低该反应的活化能 |
| B.催化剂能改变该反应的焓变 |
| C.该反应为放热反应 |
| D.由图可知,在催化剂作用下,该反应不是一步完成的 |
下列说法错误的是
| A.化学反应除了生成新的物质外,还伴随着能量的变化 |
| B.物质的燃烧一定是放热反应 |
| C.放热的化学反应不需要加热就能发生 |
| D.化学能与光能之间可以相互转化 |
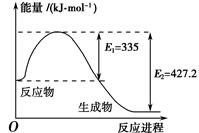
 2NH3(g) ΔH=a kJ·mol-1。
2NH3(g) ΔH=a kJ·mol-1。