题目内容
【题目】ClO2是一种具有强氧化性的黄绿色气体,也是优良的消毒剂,熔点-59℃、沸点11℃,易溶于水,易与碱液反应。ClO2浓度大时易分解爆炸,在生产和使用时必须用稀有气体或空气等进行稀释,实验室常用下列方法制备:2NaC1O3+Na2SO3+H2SO4![]() 2C1O2↑+2Na2SO4+H2O。
2C1O2↑+2Na2SO4+H2O。
(1)H2C2O4可代替Na2SO3制备ClO2,该反应的化学方程式为___,该方法中最突出的优点是___。
(2)ClO2浓度过高时易发生分解,故常将其制备成NaClO2固体,以便运输和贮存。
已知:2NaOH+H2O2+2ClO2=2NaClO2+O2+2H2O,实验室模拟制备NaC1O2的装置如图所示(加热和夹持装置略)。
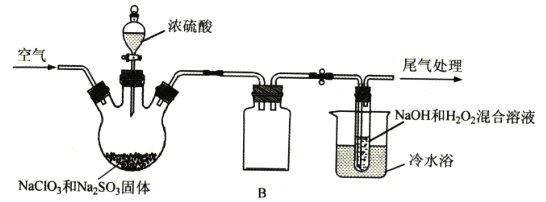
①产生ClO2的温度需要控制在50℃,应采取的加热方式是___;盛放浓硫酸的仪器为:___;NaC1O2的名称是___;
②仪器B的作用是___;冷水浴冷却的目的有___(任写两条);
③空气流速过快或过慢,均会降低NaC1O2的产率,试解释其原因___。
【答案】2NaClO3+H2C2O4+H2SO4=2ClO2↑+Na2SO4+H2O+2CO2↑ 反应中产生的CO2可以起到稀释ClO2的作用,避免ClO2浓度大时分解爆炸,提高了安全性 水浴加热 分液漏斗 亚氯酸钠 安全瓶,防倒吸 降低NaClO2的溶解度,增大ClO2的溶解度,减少H2O2分解,减少ClO2分解 空气流速过快时,ClO2不能被充分吸收:空气流速过慢时,ClO2浓度过高导致分解
【解析】
![]() 中的氯是+4价的,因此我们需要一种还原剂将氯酸钠中+5价的氯还原,同时要小心题干中提到的易爆炸性。再来看实验装置,首先三颈烧瓶中通入空气,一方面可以将产物“吹”入后续装置,另一方面可以起到稀释
中的氯是+4价的,因此我们需要一种还原剂将氯酸钠中+5价的氯还原,同时要小心题干中提到的易爆炸性。再来看实验装置,首先三颈烧瓶中通入空气,一方面可以将产物“吹”入后续装置,另一方面可以起到稀释![]() 的作用,防止其浓度过高发生危险,B起到一个安全瓶的作用,而C是吸收装置,将
的作用,防止其浓度过高发生危险,B起到一个安全瓶的作用,而C是吸收装置,将![]() 转化为
转化为![]() ,据此来分析本题即可。
,据此来分析本题即可。
(1)用草酸来代替![]() ,草酸中的碳平均为+3价,因此被氧化产生+4价的二氧化碳,方程式为2NaClO3+H2C2O4+H2SO4=2ClO2↑+Na2SO4+H2O+2CO2↑;产生的
,草酸中的碳平均为+3价,因此被氧化产生+4价的二氧化碳,方程式为2NaClO3+H2C2O4+H2SO4=2ClO2↑+Na2SO4+H2O+2CO2↑;产生的![]() 可以稀释
可以稀释![]() ,防止其浓度过高发生危险;
,防止其浓度过高发生危险;
(2)①50℃最好的加热方式自然是水浴加热,盛放浓硫酸的仪器为分液漏斗,![]() 中的氯元素为+3价,因此为亚氯酸钠;
中的氯元素为+3价,因此为亚氯酸钠;
②仪器B是一个安全瓶,防止倒吸;而冰水浴一方面可以减少![]() 的分解,另一方面可以使
的分解,另一方面可以使![]() 变为液体,增大产率;
变为液体,增大产率;
③当空气流速过快时,![]() 来不及被充分吸收,当空气流速过慢时,
来不及被充分吸收,当空气流速过慢时,![]() 又会在容器内滞留,浓度过高导致分解。
又会在容器内滞留,浓度过高导致分解。