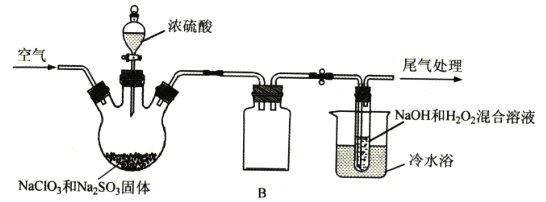
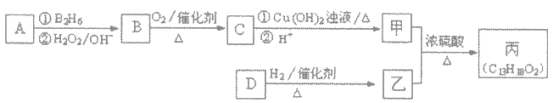
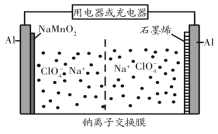
题目内容
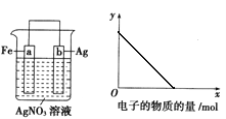
【题目】某温度下,在一个1L 的密闭容器中,X、Y、Z 三种气态物质的物质的量随时间的变化曲线如图所示。根据图中数据,填写下列空白:
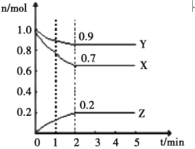
(1)2min时,Y 的物质的量浓度是____________;
(2)从开始至2min,X 的平均反应速率为_________;
(3)该反应的化学方程式为____________________;
(4)1min时,v(正)____v(逆),2min时,v(正)____v(逆) (填“>”或“<”或“=”);
(5)在2min时,向容器中通入氩气,增大体系压强,X 的化学反应速率将______;
(6)2min时,x的转化率为________。
【答案】0.9mo1L-1 0.15mo1L-1min-1 3X(g)+Y(g)2Z(g) > = 不变 30%
【解析】
由图可知,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,,Z的生成的物质的量为0.2 mol,物质的量的变化量之比为3: 1: 2,物质的量变化之比等于化学计量数之比,据此解答。
(1).由图可知:在2min时Y的物质的量为0.9mol,容器体积为1L,则Y的物质的量的浓度为:![]() ,故答案为:0.9mo1L-1;
,故答案为:0.9mo1L-1;
(2).从开始至2min,X的变化的物质的量为1mol -0.7mol=0.3mol,由公式:![]() ;故答案:0.15mo1L-1min-1;
;故答案:0.15mo1L-1min-1;
(3).由图可知,从反应开始到达到平衡,X、Y的物质的量减少,应为反应物,Z的物质的量增加,应为生成物,从反应开始到第2分钟反应到达平衡状态,X、Y消耗的物质的量分别为0.3 mol、0.1 mol,,Z的生成的物质的量为0.2 mol,物质的量的变化量之比为3: 1: 2,物质的量变化之比等于化学计量数之比,则化学方程式为3X(g)+Y(g)2Z(g),故答案为:3X(g)+Y(g)2Z(g);
(4).1min时,平衡正向进行,则正逆反应速率的大小关系为: v(正)>v (逆);2min时反应正好达到平衡,则正逆反应速率的大小关系为:V(正)=V(逆),故答案为:>;=;
(5).容器体积恒定,通入惰性气体氩气,对反应物浓度没有影响,故X的反应速率不变;故答案为:不变;
(6).![]() 则x的转化率=
则x的转化率=![]() ,故答案为:30%。
,故答案为:30%。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)①形成的阴离子的结构示意图为___。如果③原子中含8个中子,则其原子符号为___。
(2)③、④、⑤、⑥简单离子半径由小到大的顺序为___。(填离子符号)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___。
(4)设计实验证明⑧的非金属性比⑦强,用化学方程式表示___。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
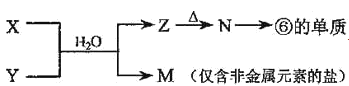
(a)X溶液与Y溶液反应的离子方程式为___。
(b)N→⑥的单质的化学方程式为___。