题目内容
【题目】元素的性质与原子结构、元素在周期表中的位置有着密切的关系。回答下列问题:
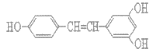
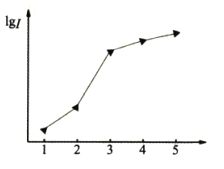
(1)如图表示某短周期元素X的前五级电离能(I)的对数值,试推测并写出X的元素符号___。
(2)化合物甲与SO2所含元素种类相同,两者互为等电子体,请写出甲的化学式___,甲分子中心原子的杂化类型是___。
(3)配位化学创始人维尔纳发现,将1mo1CoC13·5NH3(紫红色)和1mo1CoC134NH3(绿色)溶于水,加入AgNO3溶液,立即沉淀的AgCl分别为2mo1、1mol。则紫红色配合物中配离子的化学式为___,绿色配合物中Co的配位数为___。
(4)某稀土元素M的氧化物晶体为立方晶胞,其结构如图所示,图中小球代表氧离子,大球代表M离子。
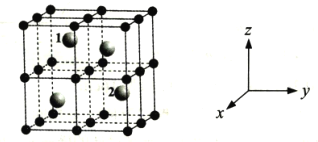
①写出该氧化物的化学式___。
②己知该晶体密度为ρg·cm-3,晶胞参数为anm,NA为阿伏加德罗常数的值。则M的相对原子质量Mr=___(用含ρ、a等的代数式表示);
③以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图中原子1(M原子)的坐标为(![]() ,
,![]() ,
,![]() ),则原子2(M原子)的坐标为___。
),则原子2(M原子)的坐标为___。
【答案】Mg S2O或OS2 sp2 [Co(NH3)5Cl]2+ 6 MO2 ![]()
![]()
【解析】
(1)根据图像可以发现该元素的第三电离能显著增大,因此推测其为第二主族元素,而铍只有4个电子,不可能有第五电离能,因此只能为镁元素,其元素符号为![]() ;
;
(2)将一个氧原子换成一个硫原子,因此的甲的化学式为![]() 或
或![]() ,
,![]() 中硫原子是
中硫原子是![]() 杂化,考虑到等电子体的结构类似,因此
杂化,考虑到等电子体的结构类似,因此![]() 分子中心原子的杂化类型也为
分子中心原子的杂化类型也为![]() ;
;
(3)根据分析,1mol紫红色的物质中有2mol![]() 位于外界,因此剩下的1mol
位于外界,因此剩下的1mol![]() 位于内界,其配离子的化学式为
位于内界,其配离子的化学式为![]() ,而1mol绿色的物质中有1mol
,而1mol绿色的物质中有1mol![]() 位于外界,因此剩下的2mol
位于外界,因此剩下的2mol![]() 位于内界,因此其配位数为4+2=6;
位于内界,因此其配位数为4+2=6;
(4)①四个大球全部位于晶胞内部,因此按1个来算,而位于顶点的氧原子按![]() 来计算,位于棱心的氧原子按
来计算,位于棱心的氧原子按![]() 来计算,位于面心的氧原子按
来计算,位于面心的氧原子按![]() 来计算,位于体心的氧原子按1个来计算,因此一共有
来计算,位于体心的氧原子按1个来计算,因此一共有![]() 个氧原子,根据分析,一个晶胞内有4个M离子和8个氧离子,因此其化学式为
个氧原子,根据分析,一个晶胞内有4个M离子和8个氧离子,因此其化学式为![]() ;
;
②分子内有4个M和8个氧,因此一个晶胞的质量为![]() ,晶体的体积为
,晶体的体积为![]() ,代入
,代入![]() 后化简即可得到
后化简即可得到![]() ;
;
③把整个晶胞划分为8个小方块,则1号小球相当于左、上、后小方块的体心,2号小球相当于右、下、后小方块的体心,因此其坐标为![]() 。
。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】在如图所示的装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体d呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
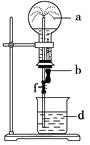
|
| |
A. |
| 水 |
B. |
| 4mol/LNaHSO3溶液 |
C. | Cl2 | 饱和NaCl水溶液 |
D. |
| 1mol/L盐酸 |
A.AB.BC.CD.D