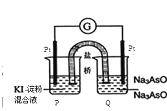
题目内容
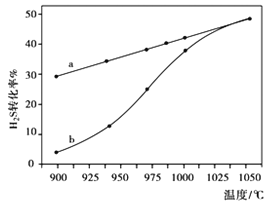
【题目】(1)在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)![]() 2NO2(g) 当n(NO):n(O2)=4:1时, O2的转化率随时间的变化关系如右图1所示。
2NO2(g) 当n(NO):n(O2)=4:1时, O2的转化率随时间的变化关系如右图1所示。
①A点的逆反应速率v逆(O2)_____B点的正反应速率v正(O2)。(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1加入一些NO和O2,当达到新平衡时,则NO的百分含量_______B点NO的百分含量(填“大于”、“小于”或“等于” )。
(2)在下图2和图3中出现的所有物质都为气体,分析图1和图2,可推测:
4NO(g)+3O2(g)="2" N2O5(g) △H=_________
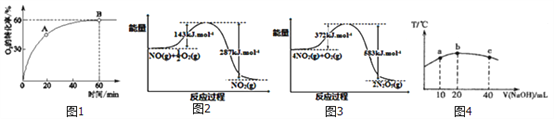
(3)若往20mL 0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图4所示,下列有关说法正确的是_______。
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO![]() )>c(OH
)>c(OH![]() )> c(H+)
)> c(H+)
【答案】(1)①小于 ② 30% , 小于 (2)-787kJ/mol(3)②③
【解析】试题分析:(1)①随着反应的进行,逆反应速率逐渐增大,所以A点的逆反应速率小于B的逆反应速率。但B点到平衡,正逆反应速率相等,所以A点逆反应速率小于B点的正反应速率。 ② 假设起始一氧化氮的物质的量为4摩尔,则氧气的物质的量为1摩尔,到平衡时氧气的转化率为60%,则反应了0.6摩尔,则根据方程式分析,一氧化氮反应了1.2摩尔,一氧化氮的转化率为1.2/4="30%" 。当达到B点,再加入一氧化氮和氧气,相当于加压,平衡正向移动,则平衡时一氧化氮的转化率增大,一氧化氮的百分含量小B点。(2)根据盖斯定律分析,反应①×4+反应②4即可以得热化学方程式:4NO(g)+3O2(g)="2" N2O5(g) △H=(143-287)×4+(372-583)=-787kJ/mol。(3)①从图分析,当氢氧化钠的体积为20毫升时体系的温度最高,说明此时完全反应,则氢氧化钠的浓度为0.01×20/20=0.01mol/L,故①错误,②正确;③酸的溶液中加入氢氧化钠,消耗氢离子,使酸的电离程度增大,故正确;④当到c点,盐和氢氧化钠的物质的量相等,则氢氧根离子浓度大于亚硝酸根离子浓度,故错误。故选②③。

 全能测控期末小状元系列答案
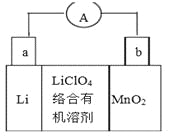
全能测控期末小状元系列答案【题目】含氮化合物是化学与工业中运用广泛的物质。

(1)该小组利用电解原理设计了如右图装置进行H2还原NO的实验(高质子导电性的SCY陶瓷(能传递H+)为介质,金属钯薄膜做电极)。铂电极B是____极,钯电极A的电极反应式为_____________。
(2)若工业废水中的NO2- 的浓度约为1.0×10-4 mol·L-1 ,取工业废水5 mL 于试管中,滴加2滴0.1 mol·L-1 的硝酸银溶液,能否看到沉淀现象?试通过计算说明。(注:1mL溶液以20滴计;Ksp(AgNO2)=2×10-8)
(3)已知键能数据,H-H 436,S=S 255,H-S 339,单位kJ/mol。请计算热化学方程式2H2(g) + S2(g) = 2H2S(g)的ΔH=___________
(4)将一定量纯净的氨基甲酸铵置于特制的密闭真空容器中(假设容器体积不变,固体试样体积忽略不计),在恒定温度下使其达到分解平衡:NH2COONH4(s)![]() 2NH3(g)+CO2(g)。
2NH3(g)+CO2(g)。
实验测得不同温度下的平衡数据列于下表:
温度(℃) | 15.0 | 20.0 | 25.0 | 30.0 | 35.0 |
平衡气体总浓度(×10-3mol/L) | 2.4 | 3.4 | 4.8 | 6.8 | 9.4 |
根据表中数据,列式计算25.0℃时的分解平衡常数:__________________________。
已知:NH2COONH4+2H2O![]() NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
NH4HCO3+NH3·H2O。该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间变化趋势如图所示。
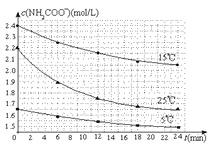
根据图中信息,如何说明水解反应速率随温度升高而增大:_____________________。