题目内容
【题目】高锰酸钾是中学化学常用的强氧化剂,实验室中可通过以下反应制得:
MnO2熔融氧化:3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
K2MnO4歧化:3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度数据见下表:
20℃ | K2CO3 | KHCO3 | K2SO4 | KMnO4 |
s(g/100g水) | 111 | 33.7 | 11.1 | 6.34 |
已知K2MnO4溶液显绿色,KMnO4溶液显紫红色。实验流程如下:

请回答:
(1)步骤①应在 中熔化,并用铁棒用力搅拌,以防结块。
A.烧杯 B.蒸发皿 C.瓷坩埚 D.铁坩埚
(2)①综合相关物质的化学性质及溶解度,步骤③中可以替代CO2的试剂是 。
A.二氧化硫 B.稀醋酸 C.稀盐酸 D.稀硫酸
②当溶液pH值达10~11时,停止通CO2;若CO2过多,造成的后果是 。
(3)烘干时,温度控制在80℃为宜,理由是 。
(4)工业上采用电解K2MnO4水溶液的方法来生产KMnO4,其中隋性电极作阳极,铁作阴极。请写出阳极的电极反应式 ,与原方法相比,电解法的优势为 。
(5)通过用草酸滴定KMnO4溶液的方法可测定KMnO4粗品的纯度(质量分数)。
①量取KMnO4溶液应选用 (填“酸式”或“碱式”)滴定管;若量取KMnO4溶液的滴定管用蒸馏水洗净后未润洗,则最终测定结果将 (填“偏大”、“偏小”或“不变”)。
②滴定过程中反应的离子方程式为______。(已知:常温下0.01 mol/L的H2C2O4溶液的pH为2.1)。
【答案】(1)D (2)①B ②CO2与K2CO3溶液反应生成KHCO3,结晶时会同KMnO4一起结晶析出,产品纯度降低 (3)温度过高,产品受热分解,温度过低,烘干时间长
(4)MnO42--e-=MnO4- K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率
(5)①酸式; 偏小 ②2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O
【解析】
试题分析:根据流程图知,①中发生反应3MnO2+KClO3+6KOH![]() 3K2MnO4+KCl+3H2O,加入蒸馏水煮沸,过滤,滤液中含有KOH、KCl、KClO3、K2MnO4,然后向溶液中通入CO2并调节溶液的pH至10-11,KOH转化为K2CO3,由于K2MnO4溶解度最小,过滤,得到K2MnO4固体,然后抽滤、洗涤烘干得到K2MnO4粗晶体;
3K2MnO4+KCl+3H2O,加入蒸馏水煮沸,过滤,滤液中含有KOH、KCl、KClO3、K2MnO4,然后向溶液中通入CO2并调节溶液的pH至10-11,KOH转化为K2CO3,由于K2MnO4溶解度最小,过滤,得到K2MnO4固体,然后抽滤、洗涤烘干得到K2MnO4粗晶体;
(1)步骤①熔融固体需要在坩埚中进行,且熔融的物质和坩埚成分不反应,由于KOH能和SiO2反应,所以应该用铁坩埚熔融,答案选D;
(2)①结合物质的化学性质及溶解度,步骤③中可以替代CO2的试剂应具有酸性,且和锰酸钾、高锰酸钾都不反应,稀盐酸和二氧化锰都能被酸性高锰酸钾溶液氧化,不能选,硫酸酸性太强,所以选醋酸,答案选B;
②当溶液pH值达10~11时,停止通CO2;若CO2过多,二氧化碳和碳酸钾反应生成碳酸氢钾,结晶时会同高锰酸钾一起析出,产品纯度降低;
(3)如果温度过低,烘干时间过长,如果温度过高,会导致高锰酸钾分解,产率降低;
(4)阳极是MnO42-失去电子转化为MnO4-,则阳极的电极反应式为MnO42--e-=MnO4-。根据电极反应式可知与原方法相比,电解法的优势为K2MnO4中的锰元素可以完全转化到KMnO4中,提高利用率。
(5)①高锰酸钾溶液具有酸性,应用酸式滴定管量取;若该滴定管用蒸馏水洗净后未润洗,会稀释溶液浓度,则最终测定结果将偏小。
②常温下0.01 mol/L的H2C2O4溶液的pH为2.1,这说明草酸是二元弱酸,则滴定过程中反应的离子方程式为2MnO4-+ 5H2C2O4 + 6H+ = 2Mn2+ + 10CO2↑+ 8H2O。

【题目】硝基苯是重要的化工原料,用途广泛。制备反应如下:
![]()

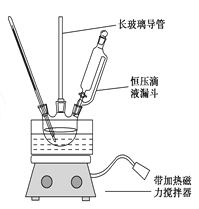
组装如右上图反应装置。 制备、提纯硝基苯流程如下:

可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃)/g · cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入 ;实验装置中长玻璃管最好用________代替(填仪器名称);恒压滴液漏斗的优点是 。
(2)反应温度控制在50~60 ℃的原因是 ;反应结束后产物在 层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是 。
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(4)固体D的名称为 。
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为 。





