题目内容
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:

反应a产生的废气直接排放可能带来的环境问题是__________ _____,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。

【答案】(1)+3,As2(SO4)3。HAsO32-+H2O ![]() H2AsO3-+OH-, >
H2AsO3-+OH-, >
(2)① 造成硫酸型酸雨 As2O3+6Zn+6H2SO4= 2AsH3 ↑+ 6ZnSO4+ 3H2O
②1:10 ③6×10-14(3)AsO43-+H2O+2e-= AsO33-+2OH- Q
【解析】
试题分析:(1)根据H3AsO3的化学式和化合价的代数和等于零可知,As的化合价为2×3-1×3=+3价;H3AsO3是两性偏酸性的化合物,它与足量硫酸反应时体现碱的性质,即生成硫酸盐:As2(SO4)3;Na2HAsO3是弱酸的酸式盐,溶液呈碱性,说明HAsO32-的水解程度大于其电离程度,则Na2HAsO3溶液呈碱性的原因是HAsO32-+H2O ![]() H2AsO3-+OH-,因为H3AsO3是多元弱酸,电离分部进行,且二级电离产生的H+对三级电离起抑制作用,所以该溶液中c(H2AsO3-)>c(AsO33-)。
H2AsO3-+OH-,因为H3AsO3是多元弱酸,电离分部进行,且二级电离产生的H+对三级电离起抑制作用,所以该溶液中c(H2AsO3-)>c(AsO33-)。
(2)①雄黄的成分是As4S4,雄黄在空气中煅烧生成砒霜(As2O3)和SO2,产生的废气SO2直接排放带来的环境问题是造成硫酸型酸雨;砒霜(As2O3)和锌、稀硫酸反应生成AsH3↑、硫酸锌和水,反应的化学方程式为As2O3+6Zn+6H2SO4= 2AsH3 ↑+ 6ZnSO4+ 3H2O。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,根据得失电子守恒和原子守恒配平,反应的化学方程式为As2S3+10HNO3 =2H3AsO4+3S+10NO2↑+2H2O,反应中还原剂是As2S3,氧化剂是硝酸,则还原剂与氧化剂的物质的量之比为1:10。
③根据Ksp(As2S3)=1×10-22,(10-5)2×c(S2-)3=1×10-22,c(S2-)=10-4mol/L,因为Ksp(FeS)=6×10-18,则10-4×c(Fe2+)=6×10-18,c(Fe2+)= 6×10-14。
(3)根据原电池总反应AsO43-+2I-+H2O![]() AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池有I2生成,即上述可逆过程向右进行,I-失电子生成I2,I-在负极放电,则正极上的电极反应式为AsO43-+H2O+2e-= AsO33-+2OH-。当电流计指针归中后向Q池中加入一定量的NaOH,导致上述平衡逆向移动,AsO33-失电子生成AsO43-,则电子由Q池流出。
AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池有I2生成,即上述可逆过程向右进行,I-失电子生成I2,I-在负极放电,则正极上的电极反应式为AsO43-+H2O+2e-= AsO33-+2OH-。当电流计指针归中后向Q池中加入一定量的NaOH,导致上述平衡逆向移动,AsO33-失电子生成AsO43-,则电子由Q池流出。

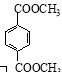
【题目】硝基苯是重要的化工原料,用途广泛。制备反应如下:
![]()

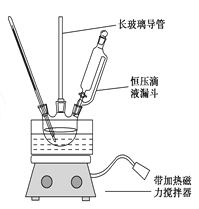
组装如右上图反应装置。 制备、提纯硝基苯流程如下:

可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃)/g · cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入 ;实验装置中长玻璃管最好用________代替(填仪器名称);恒压滴液漏斗的优点是 。
(2)反应温度控制在50~60 ℃的原因是 ;反应结束后产物在 层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是 。
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(4)固体D的名称为 。
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为 。