题目内容
【题目】有一硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,过滤、洗涤、烘干后得到9.32g的沉淀;滤液与4.0mol![]() NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
NaOH溶液反应,用去35mL碱液时恰好完全中和。试求:
(1)混合液中H2SO4、HNO3的物质的量浓度各是多少?
(2)另取l0mL原混合液,加入3.2g铜粉共热时,在标准状况下收集到气体的体积为多少升?(保留两位有效数字。)
【答案】(1)c(H2SO4)=4.0mol/L c(HNO3)=6.0mol/L;(2)0.75L
【解析】
试题分析:硫酸与硝酸的混合溶液,取出10mL加入足量BaCl2溶液,只有硫酸和BaCl2反应生成硫酸钡的沉淀,过滤、洗涤、烘干后得到9.32g的沉淀,根据质量守恒定律,n(硫酸)=n(硫酸钡)=9.32g/233g·mol-1=0.04mol,原溶液中硫酸的物质的量浓度为0.04mol/0.01L=4.0mol/L,滤液与4.0mol![]() NaOH溶液反应,用去35mL碱液时恰好完全中和,n(HNO3)=n(NaOH)-2n(硫酸)=4.0mol·L1×0.035L-2×0.04mol=0.06mol,原溶液中硝酸的物质的量浓度为:0.06mol /0.01L=6.0mol/L,答案为:c(H2SO4)=4.0mol/L c(HNO3)=6.0mol/L;(2)稀硫酸和铜不反应,加入铜粉只发生反应3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,n(Cu)=3.2g/64g/mol =0.05mol,n(H+)=n(NaOH)= 4.0mol·L1×0.035L=0.14mol,n(NO-3)=0.06mol,通过比较发现铜反应完全,所以生成的NO的物质的量为:(2/3)×0.05mol,标准状况下的体积为(2/3)×0.05mol×22.4L/mol=0.75L,答案为:0.75L.
NaOH溶液反应,用去35mL碱液时恰好完全中和,n(HNO3)=n(NaOH)-2n(硫酸)=4.0mol·L1×0.035L-2×0.04mol=0.06mol,原溶液中硝酸的物质的量浓度为:0.06mol /0.01L=6.0mol/L,答案为:c(H2SO4)=4.0mol/L c(HNO3)=6.0mol/L;(2)稀硫酸和铜不反应,加入铜粉只发生反应3Cu+8H++2NO3-=3Cu2++4H2O+2NO↑,n(Cu)=3.2g/64g/mol =0.05mol,n(H+)=n(NaOH)= 4.0mol·L1×0.035L=0.14mol,n(NO-3)=0.06mol,通过比较发现铜反应完全,所以生成的NO的物质的量为:(2/3)×0.05mol,标准状况下的体积为(2/3)×0.05mol×22.4L/mol=0.75L,答案为:0.75L.

【题目】归纳整理是科学学习的重要方法之一。氧族元素的部分性质归纳整理如下:
|
|
|
|
|
单质熔点/℃ | -218,4 | 113 | ? | 450 |
单质沸点/℃ | -183 | 444.6 | 685 | 989 |
主要化合价 | -2 | -2、+4、+6 | -2、+4、+6 | ? |
原子半径/nm | 0.074 | 0.102 | ? | 0.136 |
单质与氢化合的难易程度 | 点燃时易化合 | 加热化合 | 加热难化合 | 不能直接 |
请根据上表数据以及数据变化趋势,回答下列问题:
(1)硒的熔点范围可能是:________________;
(2)碲(Te)可能的化合价有:___________________;
(3)硒(Se)的原子半径可能在_______________________之间。
(4)从单质与氢化合的难易程度可以推测出,O、S、Se、Te的非金属性逐渐_________(增强、减弱)。
【题目】锰的用途非常广泛,以碳酸锰矿(主要成分为MnCO3,还含有铁、镍、钴等碳酸盐杂质)为原料生产金属锰的工艺流程如下:
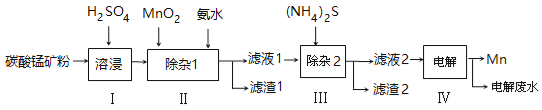
已知25℃,部分物质的溶度积常数如下:
物质 | Mn(OH)2 | Co(OH)2 | Ni(OH)2 | MnS | CoS | NiS |
Ksp | 2.1×10-13 | 3.0×10-16 | 5.0×10-16 | 1.0×10-11 | 5.0×10-22 | 1.0×10-22 |
(1)步骤Ⅰ中,为加快溶浸速率,可采取的措施是: 。(至少答两条)
(2)步骤Ⅱ中,须加氨水调节溶液的pH为5.0~6.0,则滤渣1的主要成分为 (填化学式)。已知MnO2的作用为氧化剂,则得到该成分所涉及的离子方程式为
。
(3)步骤Ⅲ中,所加(NH4)2S的浓度不宜过大的原因是 。
(4)滤液2中,c(Co2+) :c(Ni2+)= 。
(5)将质量为a㎏的碳酸锰矿经上述流程处理后得到单质Mn b kg。若每一步都进行完全,滤渣1为纯净物,质量为c kg,则原碳酸锰矿中MnCO3的质量分数为 。(用含a、b、c的式子表达,无需化简)









