题目内容
【题目】CuSO4溶液是一种较重要的铜盐试剂,在电镀、印染、颜料、农药等方面有广泛应用。某同学利用CuSO4溶液进行以下实验探究。
i. 下图是根据反应Zn+CuSO4=Cu+ZnSO4设计成的锌铜原电池。
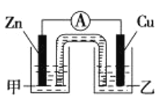
①该原电池的正极为 ____ ,其外电路中的电子是从____ 极(填“Zn”或“Cu”)流出。
②电解质溶液乙是______溶液,Zn极的电极反应式是_______ 。
③如果盐桥中的成分是K2SO4溶液,则盐桥中向左侧烧杯中移动的离子主要是_____。
ii. 下图中,Ⅰ是甲烷燃料电池(电解质溶液为KOH溶液)的结构示意图。
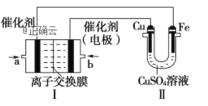
①同学想在Ⅱ中实现铁上镀铜,则Cu作____极,电极反应式为______,当线路中有0.1mol电子通过时,阴极增重_____ g。Ⅰ中消耗氧气体积是_____L(标况下)。
②a处通入的是____(填“CH4”或“O2”),b处电极上发生的电极反应式是___。Ⅰ中的总反应方程式为___。
③该同学若将Ⅱ中的两个电极都换成铂电极,当线路中有0.1mol电子通过时,测得溶液pH=______(100mL的CuSO4溶液),则Ⅱ中的总反应方程式为 _______ 。
【答案】铜(Cu) Zn CuSO4 Zn-2e-=Zn2+ SO42- 阳 Cu-2e=Cu2+ 3.2 0.56 CH4 2H2O+O2+4e-=4OH- CH4+2O2+2KOH=K2CO3+3H2O 0 2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4
2Cu+O2↑+2H2SO4
【解析】
i.原电池负极发生氧化反应,正极发生还原反应。根据反应Zn+CuSO4═Cu+ZnSO4,结合图示可知,Zn为负极,Cu为正极,盐桥中是含有琼胶的K2SO4饱和溶液,电池工作时K+向正极移动,SO42-向负极移动;
ii.利用该装置在Ⅱ中实现铁上镀铜,则铁做阴极,阴极上发生的电极反应为:Cu2++2e=Cu,铜做阳极,阳极上发生的电极反应为:Cu-2e=Cu2+,阴极与电源负极相连,燃料电池中,通入燃料的一极为负极,则a通入的为甲烷(CH4),作燃料电池的负极,负极的电极反应为:CH4+10OH--8e-= CO32-+7H2O;b通入的为氧气(或空气),作燃料电池的正极,正极的电极反应为:2H2O+O2+4e-=4OH-,据此分析解答。
i.原电池反应Zn+CuSO4═Cu+ZnSO4,结合图一可知,Zn为负极,Cu为正极;
①该原电池的正极为铜(Cu),原电池工作时外电路中电子从负极流向正极,即从Zn流出;
②原电池的正极上发生还原反应,溶液中Cu2+被还原,则电解质溶液乙是CuSO4溶液,负极Zn发生的电极反应为Zn-2e═Zn2+;
③盐桥中是含有琼胶的K2SO4饱和溶液,电池工作时,阴离子向负极移动,阳离子向正极移动,则SO42向负极(左侧烧杯)移动,K+向正极(右侧烧杯)移动;
ii.①根据分析,同学想在Ⅱ中实现铁上镀铜,则Cu作阳极,电极反应式为Cu-2e=Cu2+,铁作阴极,电极反应为Cu2++2e=Cu,当线路中有0.1mol电子通过时,阴极析出0.05mol铜单质,增重0.05mol×64g/mol=3.2g。Ⅰ中正极的电极反应为:2H2O+O2+4e-=4OH-,消耗氧气的物质的量为![]() =0.025mol,标况下体积是0.025mol×22.4L/mol=0.56L;
=0.025mol,标况下体积是0.025mol×22.4L/mol=0.56L;
②根据分析,a通入的为甲烷(CH4),作燃料电池的负极,负极的电极反应为:CH4+10OH--8e-= CO32-+7H2O;b处电极为正极,发生的电极反应式是2H2O+O2+4e-=4OH-;将正负极电极反应合并,Ⅰ中的总反应方程式为CH4+2O2+2KOH=K2CO3+3H2O;
③该同学若将Ⅱ中的两个电极都换成铂电极,电解硫酸铜溶液,阴极铜离子放电生成铜单质,电极反应为:Cu2++2e=Cu,阳极为电解水,氢氧根离子放电,电极反应为:2H2O-4e-=4H++O2↑,当线路中有0.1mol电子通过时,生成0.1mol氢离子,则溶液中氢离子浓度为![]() =1mol/L,测的溶液pH=0,则Ⅱ中的总反应方程式为2CuSO4+2H2O
=1mol/L,测的溶液pH=0,则Ⅱ中的总反应方程式为2CuSO4+2H2O![]() 2Cu+O2↑+2H2SO4。
2Cu+O2↑+2H2SO4。