题目内容
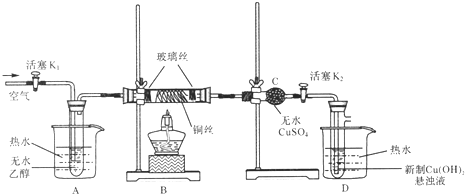
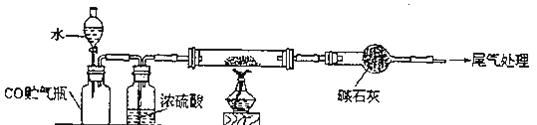
【题目】某研究性学习小组用如图装置![]() 铁架台等仪器略
铁架台等仪器略![]() 探究氧化铁与乙醇的反应,并检验反应产物。
探究氧化铁与乙醇的反应,并检验反应产物。
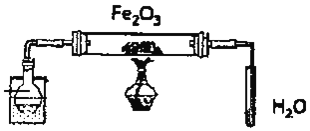
已知:![]() 乙醇的氧化产物是乙醛;
乙醇的氧化产物是乙醛;
![]() 乙醇和乙醛都易溶于水,乙醇沸点是75℃ ,是20.8℃
乙醇和乙醛都易溶于水,乙醇沸点是75℃ ,是20.8℃
(1)组装好仪器后须进行的操作是______,其方法是______
(2)圆底烧瓶中试剂的结构简式是______。
(3)本实验装置有一处不合理,如不加以改进可能会发生______。
(4)经上述实验,观察至红色的Fe2O3全部变为黑色固体。停止加热,冷却后取出硬质玻璃管中的黑色固体少许许于试管中,再加入足量稀硫酸,振荡,固体全部溶解,得到澄清溶液,实验过程中未观察到气泡产生。澄清溶液中一定含有的金属阳离子是______检验该离子的实验是______
(5)黑色固体成分用FeOx示。用下列装置测量X值。
![]() 充分反应后,停止实验的操作是_______
充分反应后,停止实验的操作是_______
![]() 实验中测得数据如下
实验中测得数据如下![]() 进行的反应己完全
进行的反应己完全![]() :
:
空硬质玻璃管的质量56.0g
硬质玻璃管和FeOx的总质量79.2g
硬质玻璃管和Fe粉的总质量72.8g(冷却到室温称量![]()
反应前干燥管及内盛物的总质量48.0g
反应后干燥管及内盛物的总质量65.6g
据上述数据计算出X=______
【答案】检查装置气密性 将导管末端伸入水中,微热烧瓶,导管末端有气泡产生,停止加热,导管末端有一段稳定的水柱,说明气密性良好 CH3CH2OH 倒吸 Fe2+ 取少量澄清溶液于试管中,滴入几滴铁氰酸钾溶液,若出现蓝色沉淀证明含亚铁离子 先停止加热,等装置冷却后,再关闭分液漏斗旋塞 ![]()
【解析】
(1)气体发生的反应是需要装置气密性检验,装置气密性检验的原理是:通过气体发生器与附设的液体构成封闭体系,依据改变体系内压强时产生的现象(如气泡的生成、水柱的形成、液面的升降等)来判断装置气密性的好坏;
(2)圆底烧瓶中试剂是乙醇;
(3)导气管直接插入水中可能会发生倒吸;
(4)经上述实验,观察至红色的Fe2O3全部变为黑色固体,停止加热,冷却后取出硬质玻璃管中的黑色固体少许于试管中,再加入足量稀硫酸,振荡,固体全部溶解,得到澄清溶液,实验过程中未观察到气泡产生说明无铁单质,则澄清溶液中一定含有的金属阳离子是为亚铁离子,检验亚铁离子的试剂是铁氰化钾检验;
(5)实验过程依据反应原理和实验目的分析实验步骤为,组装装置,检验装置气密性,加入试剂,加入水把一氧化碳赶入后续装置,点燃酒精灯加热玻璃管,反应结束后停止加热,关闭分液漏斗活塞,玻璃管称量剩余固体,依据质量变化计算铁元素和氧元素物质的量之比。
(1)依据装置图分析可知反应过程需要在气密性好的装置中进行,定量测定,所以气体通过装置,实验前需要检验装置气密性,依据装置图分析可知反应过程需要在气密性好的装置中进行,定量测定,所以气体通过装置,实验前需要检验装置气密性,方法为:将导管末端伸入水中,微热烧瓶,导管末端有气泡产生,停止加热,导管末端有一段稳定的水柱,说明气密性良好,
故答案为:检查装置气密性;将导管末端伸入水中,微热烧瓶,导管末端有气泡产生,停止加热,导管末端有一段稳定的水柱,说明气密性良好;
(2)圆底烧瓶中试剂的结构简式是:CH3CH2OH,
故答案为:CH3CH2OH;
(3)本实验装置有一处不合理,如不加以改进可能会发生倒吸,
故答案为:倒吸;
(4)经上述实验,观察至红色的Fe2O3全部变为黑色固体,停止加热,冷却后取出硬质玻璃管中的黑色固体少许于试管中,再加入足量稀硫酸,振荡,固体全部溶解,得到澄清溶液,实验过程中未观察到气泡产生说明无铁单质,则澄清溶液中一定含有的金属阳离子是为亚铁离子,检验亚铁离子的试剂是铁氰化钾检验,方法为:取少量澄清溶液于试管中,滴入几滴铁氰酸钾溶液,若出现蓝色沉淀证明含亚铁离子,
故答案为:Fe2+;取少量澄清溶液于试管中,滴入几滴铁氰酸钾溶液,若出现蓝色沉淀证明含亚铁离子;
(5)①充分反应后,停止实验的操作是:先停止加热,等装置冷却后,再关闭分液漏斗旋塞,
故答案为:先停止加热,等装置冷却后,再关闭分液漏斗旋塞;
②空硬质玻璃管的质量56.0g
硬质玻璃管和FeOx的总质量79.2g
,FeOx质量=79.2g-56.0g=23.2g,
硬质玻璃管和Fe粉的总质量72.8g(冷却到室温称量![]() ,生成Fe的质量=72.8g-56.0g=16.8g,物质的量
,生成Fe的质量=72.8g-56.0g=16.8g,物质的量![]() ,
,
反应前干燥管及内盛物的总质量48.0g,反应后干燥管及内盛物的总质量65.6g,为生成二氧化碳气体的质量=65.6g-48.0g=17.6g,二氧化碳物质的量![]() ,
,
所含O元素物质的量![]() ,则FeOx中
,则FeOx中![]() ,
,![]() ,
,
故答案为:![]() 。
。