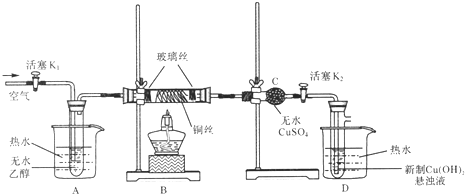
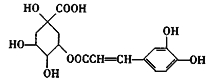
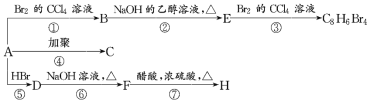
��Ŀ����
����Ŀ������������Ũ�Ⱦ�Ϊ0.01mol/L�ļ�����Һ�������� �ڴ���۰�ˮ�� NaOH��Һ���ش��������⣺
(1)�ڵĵ��뷽��ʽΪ________ �� �ۣ�����ˮ�ĵ���̶Ƚϴ����______
(2)�����£���Һ������ˮ�������c(H+)=______�����¶����ߵ�100���϶�ʱ��(Kw=1��10-12)��Һ�ܵ�pH= ______
(3)���١��۵������ϣ�������Һ��______ (���ᣬ�����)�ԡ�
(4)���ڡ��ܵ������Ϻ�����Һ�����ԣ�����������Һ�����Ϊ��_____ ��(����>������<������=��)
(5)����ʱ�����ñ���Һ�ٵζ��ܣ��ζ������У���Ҫ����_______��ָʾ�����ζ��յ���жϷ�����_________��
���𰸡�CH3COOHCH3COO-��H+ �� 1.0��10-12mol/L 10 ���� �� ��̪ ��Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��˵����Ӧ�ﵽ�յ�
��������
(1)����Ϊ���ᣬӦ�ÿ���������ӣ�NaOHΪǿ���ˮ�ĵ���̶����ƽϴ�
(2) ����Kw=c(H+)c(OH-)���㼴�ɣ�
(3)������Ϊǿ�������Σ�Ϊ������Һ��
(4)�����߸պ÷�Ӧ��ȫ����Һ�ʼ��ԣ�ʵ�ʳ����ԣ����������
(5)����Һ�ʼ��ԣ��÷�̪��ָʾ����
(1)����Ϊ���ᣬӦ�ÿ���������ӣ����뷽��ʽΪCH3COOHCH3COO-��H+����ˮ�����NaOHΪǿ���ˮ�ĵ��붼���������ã�Ũ�Ⱦ�Ϊ0.01mol/L��NaOH��Һ������������Ũ�ȴ�ˮ�ĵ���̶����ƽϴʴ�Ϊ����
(2) ����Ϊǿ�ᣬ��Һ����ȫ���룬Ũ��Ϊ0.01mol/L����������c(H+)=0.01mol/L��Ũ��Ϊ0.01mol/LNaOH��Һ������������Ũ��0.01mol/L��100���϶�ʱ������Kw=c(H+)c(OH-)����c(H+)=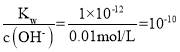 ����pH=10��
����pH=10��
(3)������������������������Ͱ�ˮǡ����ȫ��Ӧ�����Ȼ����Һ��笠�����ˮ�⣬���ӷ���ʽΪ��NH4++H2ONH3H2O+H+����Һ�����ԣ�
(4)�������ᡢ��NaOH��Һ�������������ɵĴ�����Ϊǿ�������Σ���Һ�Լ��ԣ�����Һ�����ԣ���Ӧ������������������Һ�������������
(5)����ʱ�����ñ�������Һ�ζ�NaOH��Һ������Һ�ʼ��ԣ��÷�̪��ָʾ�����ζ��յ���жϷ����ǣ��������һ�������Һ����Һ����ɫ��Ϊdz��ɫ���Ұ�����ڲ���ɫ��˵����Ӧ�ﵽ�յ㡣

 ��Ԫ����ĩ��ϰ�ȷ��ϵ�д�
��Ԫ����ĩ��ϰ�ȷ��ϵ�д� ����ͬ�����Ծ�ϵ�д�
����ͬ�����Ծ�ϵ�д�����Ŀ���о�����ȿ���CO��CO2��Ӧ�öԹ�����̬������������Ҫ�����塣
��1��CO��������������֪��Fe2O3��s��+ 3C��s����2Fe��s��+ 3CO��g�� ��H 1��+489.0 kJ��mol��1
C��s�� +CO2��g����2CO��g�� ��H 2 ��+172.5 kJ��mol��1����CO��ԭFe2O3��s�����Ȼ�ѧ����ʽΪ_________________________________________________��
��2�������¯ú���õ���CO���������Ƴ�ȼ�ϵ�أ���KOH��ҺΪ���Һ����д���õ�صĸ�����Ӧʽ��__________________________________________________��
��3����CO2��H2����һ��������ܱ������У��������¶��·�����Ӧ��CO2��g��+3H2��g��![]() CH3OH��g��+H2O��g�������CH3OH�����ʵ�����ʱ��ı仯��ͼ��������I�����Ӧ��ƽ�ⳣ����С��ϵΪK��___________________K��������������������������������
CH3OH��g��+H2O��g�������CH3OH�����ʵ�����ʱ��ı仯��ͼ��������I�����Ӧ��ƽ�ⳣ����С��ϵΪK��___________________K��������������������������������
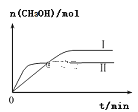
��һ���¶��£����ݻ���ͬ�ҹ̶��������ܱ������У������·�ʽ���뷴Ӧ�һ��ʱ���ﵽƽ�⡣
�� �� | �� | �� |
��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��b molH2�� c molCH3OH��g����c molH2O��g�� |
������ƽ��������ѹǿΪ��ʼ��0.8����Ҫʹƽ������������ͬ��ֵ����������ȣ�����ʼʱά�ֻ�ѧ��Ӧ���淴Ӧ������У���c��ȡֵ��ΧΪ______________________��
��һ���¶��£��˷�Ӧ����ѹ�����н��У����жϸ÷�Ӧ�ﵽ��ѧƽ��״̬��������______________��
a��������ѹǿ���� b��H2������������� c��c��H2����3c��CH3OH��
d���������ܶȲ��� e��2��C��O���ѵ�ͬʱ��3��H��H����
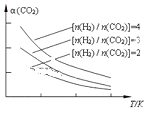
��4����ȼú�����е�CO2ת��Ϊ�����ѵķ�Ӧԭ��Ϊ��2CO2��g�� + 6H2��g��![]() CH3OCH3��g�� + 3H2O��g������֪һ�������£��÷�Ӧ��CO2��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO2)]�ı仯������ͼ�����¶Ȳ��䣬���Ͷ�ϱ�n(H2)/n(CO2)����K��__________���÷�Ӧ��H_________0����������������������=������
CH3OCH3��g�� + 3H2O��g������֪һ�������£��÷�Ӧ��CO2��ƽ��ת�������¶ȡ�Ͷ�ϱ�[n(H2) / n(CO2)]�ı仯������ͼ�����¶Ȳ��䣬���Ͷ�ϱ�n(H2)/n(CO2)����K��__________���÷�Ӧ��H_________0����������������������=������